题目内容
5.下列各组顺序的排列错误的是( )| A. | 半径:F->Na+>Mg2+>Al3+ | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>CO2 |
分析 A、电子层结构相同,核电荷数越大半径越小;
B、氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、根据熔点:原子晶体>离子晶体>分子晶体分析.
解答 解:A、电子层结构相同时,原子序数越大,半径越小,则离子半径:F->Na+>Mg2+>Al3+,故A正确;
B、氢化物的相对分子质量越大,沸点越高,水分子间含有氢键的沸点较高,则氢化物熔沸点:H2O>H2Se>H2S,故B错误;
C、非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性:H3PO4<H2SO4<HClO4 故C正确;
D、SiO2为原子晶体,NaCl为离子晶体,CO2为分子晶体,熔点顺序:原子晶体>离子晶体>分子晶体,故D正确;
故选B.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
8.用以下方法制取氢气,反应速率最小的是( )
| A. | 冬天,块状的锌与2mol/L稀硫酸溶液反应 | |
| B. | 冬天,粉末状的锌与2mol/L稀硫酸溶液反应 | |
| C. | 夏天,块状的锌与2mol/L稀硫酸溶液反应 | |
| D. | 夏天,粉末状的锌与2mol/L稀硫酸溶液反应 |
16.通常用来衡量一个国家石油化工发展水平的标志是( )
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 汽油的产量 | D. | 合成纤维的产量 |
13.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | 氢氧化钠与稀盐酸反应 | B. | 锌与稀硫酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 灼热的炭与二氧化碳反应 |
20.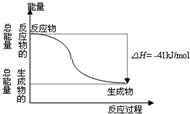 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
 CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )
CO(g)与H2O(g)反应生成CO2(g)与H2(g)过程的能量变化如图所示,有关两者反应的说法正确的是( )| A. | 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 | |
| B. | 该反应为放热反应 | |
| C. | 反应的热化学方程式是:CO(g)+H2O (g)=CO2(g)+H2(g)△H=+41kJ/mol | |
| D. | CO(g)与H2O(g)所具有的总能量小于CO2(g)与H2(g)所具有的总能量 |
10.下列关于营养物质的说法正确的是( )
| A. | 油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物 | |
| B. | 油脂经皂化反应后,可用饱和食盐水使硬脂酸钠析出 | |
| C. | 2mol蔗糖的水解产物是1mol葡萄糖和1mol果糖 | |
| D. | 淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜 |
17.(Ⅰ)观察图A、B、C,回答下列问题:
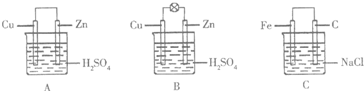
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol/L、c(ZnSO4)=1mol/L.
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式O2+2H2O+4e-=4OH-.
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是温度升高H2O2的分解速率加快,导致H2O2的浓度降低从而使铜的溶解速率慢.

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片没有(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为2H++2e-=H2↑.
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=1mol/L、c(ZnSO4)=1mol/L.
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式O2+2H2O+4e-=4OH-.
(Ⅱ)将铜粉末用10%H2O2和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
14.表中实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 向苯酚溶液中滴加稀溴水 | 观察白色沉淀三溴苯酚 |
| B | 向待测液中加入碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3ml5%CuSO4溶液中滴加3-4滴2%氢氧化钠溶液,再向其中加入0.5ml乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
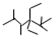 的名称是2,2,4,5-四甲基-3,3-二乙基庚烷,
的名称是2,2,4,5-四甲基-3,3-二乙基庚烷,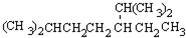 的名称为2,6-二甲基-3-乙基庚烷.
的名称为2,6-二甲基-3-乙基庚烷. ,
,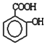 )滴入Na2CO3溶液中发生的化学方程式:
)滴入Na2CO3溶液中发生的化学方程式: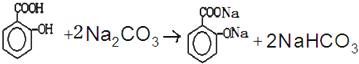 ,
,