题目内容
【题目】某同学类比镁在二氧化碳中的燃烧反应:2Mg+CO2=2MgO+C,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。
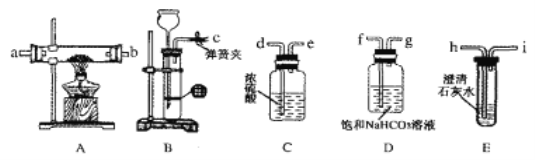
依据要求回答问题:
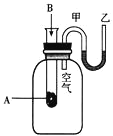
(1)二氧化碳的发生装置应选用上述装置中的__(填装置下方对应字母),反应的离子方程式为___。
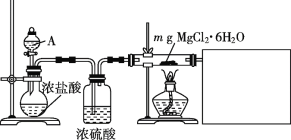
(2)为达到实脸目的,选择上图中的装置,其连接顺序为:二氧化碳的发生装置→___。(按气流方向,用小写字母表示)。
(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。能说明装置中空气已经排净的现象是___。
(4)若反应过程中CO2足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为Na2CO3,②生成的固体物质为Na2CO3和C的混合物,③生成的固体物质为Na2CO3和Na2O的混合物,④生成的固体物质为Na2O和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是___;则钠与CO2反应的化学方程式为___。
(5)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,PdCl2溶液可以吸收CO,同时得到黑色的Pd。于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为___。
【答案】B CaCO3+2H+=Ca2++CO2↑+H2O f→g→d→e→a→b→h→i E装置中澄清石灰水变浑浊 在加热条件下过量的二氧化碳可以和碳、氧化钠发生反应,反应结束后硬质玻璃管中应不含有C和氧化钠 2Na+2CO2![]() Na2CO3+CO CO+PdCl2+H2O=Pd↓+CO2+2HCl
Na2CO3+CO CO+PdCl2+H2O=Pd↓+CO2+2HCl
【解析】
(1)二氧化碳制备用大理石和稀盐酸反应生成,固体和液体混合反应生成气体,选择装置B,随时进行随时停止,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)制备得到二氧化碳中含杂质气体氯化氢和水蒸气,需要用饱和碳酸氢钠溶液除去氯化氢,用浓硫酸除去水蒸气,再通过装置A和钠反应,最后用澄清石灰水检验或除去尾气中的二氧化碳,特别注意气体经过溶液导气管需要长进短出,则其连接顺序为:二氧化碳的发生装置→f→g→d→e→a→b→h→i;
(3)利用发生装置中生成的二氧化碳排净装置中空气,E中变浑浊证明空气排净,检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯,能说明装置中空气已经排净的现象是E装置中澄清石灰水变浑浊,点燃酒精灯进行钠与二氧化碳的反应;
(4)在加热条件下过量的二氧化碳可以和碳、氧化钠发生反应,反应结束后硬质玻璃管中应不含有C和氧化钠,二氧化碳与单质炭反应C+CO2![]() 2CO,所以②错误,氧化钠与二氧化碳反应生成碳酸钠,方程式为:Na2O+CO2=Na2CO3,所以③、④错误,三个结论不符合,故①正确;钠与二氧化碳反应生成碳酸钠,反应中钠做还原剂,二氧化碳做氧化剂被还原为CO,反应的化学方程式为:2Na+2CO2
2CO,所以②错误,氧化钠与二氧化碳反应生成碳酸钠,方程式为:Na2O+CO2=Na2CO3,所以③、④错误,三个结论不符合,故①正确;钠与二氧化碳反应生成碳酸钠,反应中钠做还原剂,二氧化碳做氧化剂被还原为CO,反应的化学方程式为:2Na+2CO2![]() Na2CO3+CO;
Na2CO3+CO;
(5)PdCl2溶液吸收CO,同时得到黑色的Pd,Pd化合价降低,则碳的化合价升高,则生成二氧化碳,根据得失电子守恒以及原子守恒,反应方程式为:CO+PdCl2+H2O=Pd↓+CO2+2HCl。

 阅读快车系列答案
阅读快车系列答案【题目】将一铁、铜混合物粉末平均分成三等份,分别加入到同浓度、不同体积的稀硝酸中,充分反应后,收集到NO气体的体积及剩余固体的质量如表 (设反应前后溶液的体积不变,气体体积已换算为标准状况时的体积):
实验序号 | 稀硝酸的体积/mL | 剩余固体的质量/g | NO的体积/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
下列说法正确的是( )
A. 表中V=7.84 L
B. 原混合物粉末的质量为25.6 g
C. 原混合物粉未中铁和铜的物质的量之比为2:3
D. 实验3所得溶液中硝酸的物质的量浓度为0.875 molL﹣1