题目内容
【题目】下列各组表述中,两种微粒不属于同种元素原子的是![]()
A.M层全充满而N层为![]() 的原子和位于第四周期第IB族的原子
的原子和位于第四周期第IB族的原子
B.2p能级有一个空轨道的基态原子和最外层电子数是次外层电子数二倍的原子
C.价电子排布为![]() 的原子和原子序数为20的原子
的原子和原子序数为20的原子
D.3p能级有两个空轨道的基态原子和M层电子数为1的原子
【答案】D
【解析】
A.M层全充满而N层为![]() 的原子的核外电子排布为
的原子的核外电子排布为![]() ,为铜,位于第四周期第IB族的原子,选项A不选;
,为铜,位于第四周期第IB族的原子,选项A不选;
B.2p能级有一个空轨道的基态原子,该原子2p能级有2个电子,是C,最外层电子数是次外层电子数二倍的原子为C,属于同种元素原子,选项B不选;
C.价电子排布为![]() 的原子的核外电子排布为
的原子的核外电子排布为![]() ,是Ca,原子序数为20,选项C不选;
,是Ca,原子序数为20,选项C不选;
D.3p能级有两个空轨道的基态原子,该原子3p能级有1个电子,是Al,M层电子数为1的原子为钠,选项D选;
答案选D。

 口算能手系列答案
口算能手系列答案【题目】最近全国各地持续出现雾霾天气,其首要污染物是可吸入颗粒物PM2.5和氮、硫的氧化物(PM2.5直径接近2.5×10-6m,1纳米=10-9m),主要来源为工业废气、机动车尾气等。因此对PM2.5、SO2、NOx进行研究、处理意义重大。
(1) 下列关于PM2.5说法正确的是_______
a.PM2.5在空气中形成了胶体;
b.PM2.5表面积大,能吸附大量有毒、有害物质;
c.少开私家车,尽量选择公交、地铁出行,某种程度可以减少PM2.5污染
(2) 取PM2.5样本用蒸馏水处理制得试样,若测得该试样所含水溶性无机离子及其平均
浓度如下表
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中的数据判断该试样的酸碱性为_______,其pH=______。
(3)对汽车尾气中的NOx进行研究
①NOx能形成酸雨,写出NO2转化为HNO3的化学方程式___________。
②汽车尾气系统中装有催化转化器,可将NOx还原成N2排出,已知下列热化学方程式:
ⅰ N2(g) +O2(g)![]() 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1
ⅱ 2C(s)+ O2(g)![]() 2CO(g) △H =- 221.0 kJ·mol-1
2CO(g) △H =- 221.0 kJ·mol-1
ⅲ C(s)+ O2(g)![]() CO2( g) △H =- 393.5 kJ·mol-1
CO2( g) △H =- 393.5 kJ·mol-1
温度升高,反应ⅲ化学平衡常数_________。(填“增大”或“减小”或“不变”)
写出NO(g)和CO(g) 反应生成N2(g) CO2(g)的热化学方程式_______________。
(4)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等
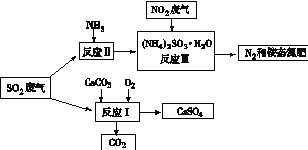
①写出反应Ⅰ的化学方程式:________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是___________。
③检验经过反应Ⅲ得到的氨态氮肥中SO42-所用试剂是________________。
