题目内容
14.试用电子式表示下列过程(1)MgCl2:

(2)Br2:
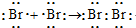
(3)H2O:
 .
.
分析 (1)镁原子最外层有两个电子易失去最外层的2个电子形成稳定的镁离子,卤原子最外层有7个电子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁;
(2)Br原子之间形成1个共用电子对;
(3)H2O为共价化合物,每个O原子与2个H原子形成2个共用电子对,O原子达到8电子稳定结构.
解答 解:(1)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为: ;
;
故答案为: ;
;
(2)Br2中Br原子之间形成1个共用电子对,用电子式表示形成过程为: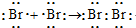 ,故答案为:
,故答案为: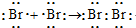 ;
;
(3)H2O为共价化合物,每个O原子与2个H原子形成2个共用电子对,O原子达到8电子稳定结构,用电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别,能够用电子式正确表示化合物的形成过程.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
4.下列化学用语书写正确的是( )
| A. | NH3的电子式: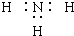 | |
| B. | 氯气的化学式:Cl | |
| C. | 氮气的电子式: | |
| D. | 硫酸铝的电离方程式:Al2(SO4)3═Al3++SO42- |
5.某溶液中放入铝片后生成大量气泡,则在此溶液中( )
| A. | 可能含有大量的H+ | B. | 可能含有大量的H+和OH- | ||
| C. | 不可能含有H+和OH- | D. | 不可能含有大量的OH- |
2.已知在100℃的温度下,水的离子积KW=1×10-12(本题涉及的溶液温度均为100℃)下列说法正确的是( )
| A. | 0.05 mol•L-1的H2SO4溶液pH=1 | |
| B. | 0.001 mol•L-1的NaOH溶液pH=11 | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL |
9.下列有关物质性质的应用正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 生石灰能与水反应,可用来干燥氯气 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
19.将反应Zn+CuSO4═ZnSO4+Cu设计成原电池.下列判断不正确的是( )


| A. | 若设计成图甲所示的原电池,电极A、B分别是Zn、Cu | |
| B. | 若设计成图乙所示的原电池,D电极反应式为:Cu2++2e-═Cu | |
| C. | 原电池乙工作时,盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液 | |
| D. | 其他条件相同时,原电池甲比原电池乙的可储存时间长 |
6.有A、B、C、D四种金属,投入水中只有D反应放出氢气,A、C用导线相连时后浸入稀硫酸中,C为正极,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
3.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:④Mg;⑫Br.
(2)画出原子的结构示意图:⑤ ;⑪
;⑪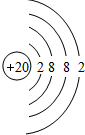 .
.
(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:⑤
 ;⑪
;⑪ .
.(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)