题目内容
某研究性学习小组为合成1 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线:
CH3CH CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO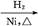 CH3CH2CH2CH2OH;
CH3CH2CH2CH2OH;
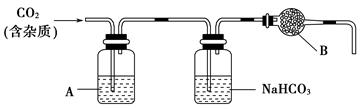
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2 丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , 。c和d中盛装的试剂分别是 , 。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)。
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④无水CuSO4;⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 。
a.低温、高压、催化剂
b.适当的温度、高压、催化剂
c.常温、常压、催化剂
d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1 丁醇粗品。为纯化1
丁醇粗品。为纯化1 丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)
丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)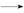 RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 丁醇 118℃,并设计出如下提纯路线:
丁醇 118℃,并设计出如下提纯路线:
粗品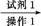 滤液
滤液
 有机层
有机层 1
1 丁醇、乙醚
丁醇、乙醚 纯品
纯品
试剂1为 ,操作1为 ,操作2为 ,操作3为 。
(1)Zn+2HCl ZnCl2+H2↑
ZnCl2+H2↑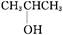
 CH3CH
CH3CH CH2↑+H2O
CH2↑+H2O
(3)④⑤①②③(或④⑤①③②)
(4)b (5)饱和NaHSO3溶液 过滤 萃取 蒸馏
解析

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案三苯甲醇(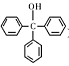 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。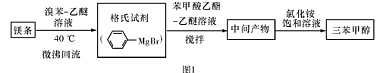
已知:(I)格氏试剂容易水解: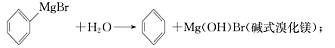
(Ⅱ)相关物质的物理性质如下: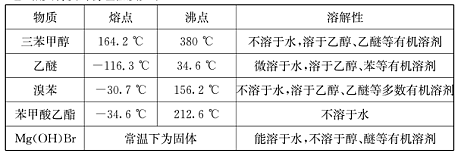
(Ⅲ)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。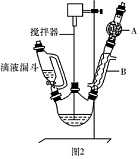
请回答以下问题:
(1)图2中玻璃仪器B的名称: ;装有无水CaCl2的仪器A的作用是 。
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持微沸,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:
其中,①操作为: ;洗涤液最好选用 (从以下选项中选择);
| A.水 | B.乙醚 | C.乙醇 | D.苯 |
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL。则产品中三苯甲醇的质量分数为 。
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验 小组 | 称取CuSO4 的质量/g | 装置C增加 的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:________________________________________________________;
第二小组:________________________________________________________。
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下: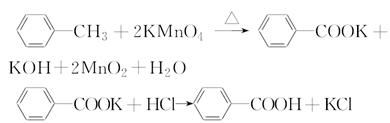
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】 30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)图中支管的作用是_______________________。
(2)冷凝管的作用是________;进水口为________(填“a”或“b”)。
(3)相对于用酒精灯直接加热,用沸水浴加热的优点是________;在本实验中,三颈烧瓶最合适的容积是________(填字母)。
| A.50 mL | B.100 mL | C.200 mL | D.250 mL |
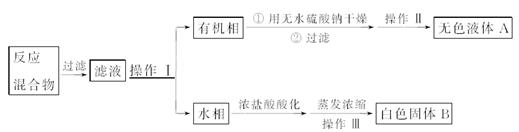
(4)操作Ⅰ的名称是________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是________。
(5)操作Ⅲ的名称是________。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
| A.烧杯 | B.试管 | C.玻璃棒 | D.分液漏斗 E.漏斗 F.酒精灯 |
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是_________________________。
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是__________________________________________。
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤 b.蒸发、浓缩 c.萃取、分液 d.冷却、结晶
草酸(H2C2O4)是一种弱酸,在工业中有重要作用。某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁,热水浸泡,经过滤得到溶液,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤沉淀备用,然后对生成的沉淀进行探究。
(1)草酸盐溶液呈弱碱性的原因是_____________________________________。
(2)该同学对生成的沉淀进行定性探究。
①提出合理假设。
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:___________________________________________________________。
②基于假设2,设计实验方案,进行实验。请在下表中写出实验步骤以及预期现象和结论。限选实验试剂:
1 mol·L-1 H2SO4、0.1 mol·L-1盐酸、0.01 mol·L-1 KMnO4溶液、澄清石灰水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入_________________________________ ________________________________ | _______________________________ _______________________________ 说明沉淀中有CaCO3 |
| 步骤2:_________________________ ________________________________ | ________________________________ |
(3)基于假设3,另一位同学对生成的沉淀进行定量探究。用稀盐酸溶解生成的沉淀,并加水配制成100 mL溶液。每次准确移取25.00 mL该溶液,用0.010 mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。若菠菜样品的质量为m g,则菠菜中草酸及草酸盐(以C2O42—计)的质量分数为________。