题目内容
【题目】(1)配平下列方程式,用双线桥法表示出电子转移的数目。 Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 + H2O ,____________,氧化剂 ________ ,氧化产物 __________
(2)用单线桥法表示下列氧化还原反应敀关系, 并标出电子转移的数目。用MnO2氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl溶液,反应得到澄清溶液。反应的化学方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①该反应的离子方程式为: _____________________________________________,该盐酸的物质的量浓度为___________mol/L。
②氧化剂与还原剂物质的量之比为_______________
③8.7gMnO2与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______,__________。
④如果该反应转移1mol电子,则生成标准状况下的气体体积为___________L。
【答案】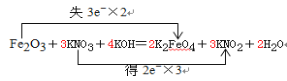 KNO3 K2FeO4
KNO3 K2FeO4 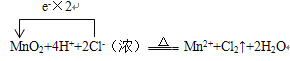 11.9 1:2 0.2
11.9 1:2 0.2 ![]() 11.2
11.2
【解析】
本题主要考查氧化还原方程的配平与计算。
(1)Fe2O3失去电子为还原剂得到K2FeO4氧化产物,KNO3得到电子为氧化剂,依据得失电子守恒和原子数守恒配平方程。
(2)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中MnO2为氧化剂,HCl为还原剂,由得失电子守恒计算相关物质。
MnCl2+Cl2↑+2H2O中MnO2为氧化剂,HCl为还原剂,由得失电子守恒计算相关物质。
(1)Fe2O3失去电子为还原剂得到K2FeO4氧化产物,KNO3得到电子为氧化剂,依据得失电子守恒和原子数守恒配平方程: ,故答案为:
,故答案为: ;KNO3;K2FeO4;
;KNO3;K2FeO4;
(2)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中MnO2为氧化剂,HCl为还原剂,由得失电子守恒和原子数守恒可知离子方程式为:
MnCl2+Cl2↑+2H2O中MnO2为氧化剂,HCl为还原剂,由得失电子守恒和原子数守恒可知离子方程式为: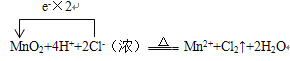 ,盐酸物质的量浓度
,盐酸物质的量浓度![]() 。氧化剂为:MnO2,还原剂为:Cl-;由得失电子可知氧化剂与还原剂物质的量之比为1:2;
。氧化剂为:MnO2,还原剂为:Cl-;由得失电子可知氧化剂与还原剂物质的量之比为1:2;
8.7gMnO2物质的量n=8.7g÷87g/mol=0.1mol,所以被氧化的HCl为0.2mol;还原过程为![]() ;转移1mol电子,则生成标准状况下的Cl2体积为0.5mol×22.4L·mol-1=11.2L。故答案为:
;转移1mol电子,则生成标准状况下的Cl2体积为0.5mol×22.4L·mol-1=11.2L。故答案为: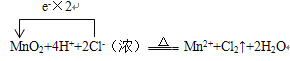 ;11.9;1:2;0.2;
;11.9;1:2;0.2;![]() ;11.2。
;11.2。

 阅读快车系列答案
阅读快车系列答案