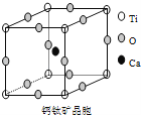
ЬтФПФкШн
ЁОЬтФПЁПЮЊбаОПввДМНсЙЙМАЦфВПЗжЕФЛЏбЇаджЪЃЌНјааЯТСаЪЕбщЁЃЭъГЩЯТСаЮЪЬтЃК
ЂёЃЎгУШчЭМзАжУРДЭЦВтввДМЕФНсЙЙЪНЁЃ
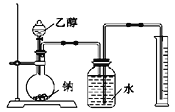
ЃЈ1ЃЉЪЕбщжаФЦашвЊЗлЫщГЩКмаЁЕФПХСЃЃЌЦфдвђЪЧ__________ЁЃ
ЃЈ2ЃЉСНДЮЪЕбщЦНОљгУввДМ1.15ПЫЃЌЪеМЏЕНЦјЬхЬхЛ§ЦНОљЮЊ0.28Щ§ЃЈЛЛЫуГЩБъзМзДЬЌЃЉЁЃгЩЪЕбщЪ§ОнПЩвдЭЦВтввДМЗжзгЕФНсЙЙЃЌвРОнЪЧ________ЁЃ
ЃЈ3ЃЉШєЪЙгУЕФввДМжаКЌгаЩйСПЕФЫЎЃЌдђЪеМЏЕНЧтЦјЕФЬхЛ§________ЁЃЃЈЦЋДѓЁЂЦЋаЁЁЂЮогАЯьЃЉ
ЂђЃЎРћгУЯТСазАжУНјааввДМЕФДпЛЏбѕЛЏЪЕбщЃЌВЂМьбщЦфВњЮяЃЌЦфжаCзАжУЕФЪдЙмжаЪЂгаЮоЫЎввДМЁЃ(ЙЬЖЈКЭМаГжзАжУвбТдШЅ)
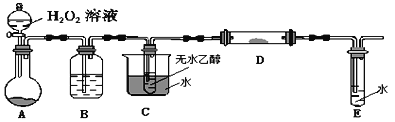
ЃЈ4ЃЉзАжУAдВЕзЩеЦПФкЕФЙЬЬхЮяжЪЪЧ________ЃЌCжаШШЫЎЕФзїгУЪЧ__________ЁЃ
ЃЈ5ЃЉЪЕбщЙ§ГЬжаDзАжУПЩвдЙлВьЕНЕФЪЕбщЯжЯѓЮЊ_______ЁЃаДГіDДІЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪН__________ЁЃЪЕбщНјаавЛЖЮЪБМфКѓЃЌШчЙћГЗШЅDДІОЦОЋЕЦЃЌЗДгІФмЗёМЬајНјааЃП_____ЁЃдвђЪЧ_______ЁЃ
ЃЈ6ЃЉМьбщEжаЕФЩњГЩЮя__________ЁЃ
ЁОД№АИЁПдіДѓНгДЅУцвдЬсИпЗДгІЫйТЪ ЭЈЙ§МЦЫуЃЌ2molввДМгызуСПФЦЗДгІЩњГЩ1molЧтЦјЃЌЫЕУї1molввДМЗжзгжаДцдк1molЛюЦУЧтдзг ЦЋДѓ MnO2 дЄШШЗДгІЛьКЯЦјЬх ССЁЊКкНЛЬцГіЯж 2CH3CH2OHЃЋO2![]() 2CH3CHOЃЋ2H2O Фм ИУЗДгІБОЩэЗХШШ дкНрОЛЪдЙмжаМгШыаТжЦЧтбѕЛЏЭаќзЧвКЃЌМгШыEжаШмвКЃЌМгШШжѓЗаЃЌЪдЙмжаГіЯжзЉКьЩЋГСЕэЃЌЫЕУїЩњГЩСЫввШЉ
2CH3CHOЃЋ2H2O Фм ИУЗДгІБОЩэЗХШШ дкНрОЛЪдЙмжаМгШыаТжЦЧтбѕЛЏЭаќзЧвКЃЌМгШыEжаШмвКЃЌМгШШжѓЗаЃЌЪдЙмжаГіЯжзЉКьЩЋГСЕэЃЌЫЕУїЩњГЩСЫввШЉ
ЁОНтЮіЁП
(1)ФЦгыввДМЕФЗДгІБШНЯЛКТ§ЃЌДгЗДгІЫйТЪЕФНЧЖШЛиД№ЃЛ
(2)ФЦгыввДМЗДгІЗХГіЧтЦјЃЌМЦЫуГіЩњГЩЕФЧтЦјЕФЮяжЪЕФСПКЭЪЙгУЕФввДМЕФЮяжЪЕФСПЃЌНсКЯЖўепЕФБШР§ЙиЯЕНтД№ЃЛ
(3)ИљОн2Na + 2H2O=2NaOH + H2ЁќКЭ2CH3CH2OH+2NaЁњ2CH3CH2ONa + H2ЁќЗжЮіХаЖЯЃЛ
(4)AЪЧЩњГЩбѕЦјЕФзАжУЃЌНсКЯЙ§бѕЛЏЧтЕФаджЪЗжЮіХаЖЯAдВЕзЩеЦПФкЕФЙЬЬхЮяжЪЃЛввДМвзЛгЗЂЃЌИУЗДгІашвЊМгШШЃЌОнДЫЗжЮіНтД№ЃЛ
(5)ЭДпЛЏбѕЛЏввДМЃЌЪЕМЪЩЯАќРЈСНИіЙ§ГЬЃЌвЛИіЪЧЭгыбѕЦјЗДгІЃЌвЛИіЪЧбѕЛЏЭбѕЛЏввДМЃЌОнДЫУшЪіЪЕбщЯжЯѓКЭЪщаДЗДгІЕФЗНГЬЪНЃЛИУЗДгІЮЊЗХШШЗДгІЃЌОнДЫЗжЮіНтД№ЃЛ
(6)EжаКЌгаввШЉЃЌНсКЯввШЉЕФаджЪЗжЮіНтД№ЁЃ
(1)ФЦгыввДМЕФЗДгІБШНЯЛКТ§ЃЌЪЕбщжаНЋФЦЗлЫщГЩКмаЁЕФПХСЃЃЌПЩвддіДѓНгДЅУцвдЬсИпЗДгІЫйТЪЃЌЙЪД№АИЮЊЃКдіДѓНгДЅУцвдЬсИпЗДгІЫйТЪЃЛ
(2)ФЦгыввДМЗДгІЗХГіЧтЦјЃЌБъзМзДЬЌЯТ0.28LЧтЦјЕФЮяжЪЕФСП=![]() =0.0125molЃЌ1.15gввДМЕФЮяжЪЕФСП=
=0.0125molЃЌ1.15gввДМЕФЮяжЪЕФСП=![]() =0.025molЃЌдђ
=0.025molЃЌдђ![]() =
=![]() =
=![]() ЃЌЫЕУї1molввДМЗжзгжаДцдк1molЛюЦУЧтдзгЃЌЙЪД№АИЮЊЃКЭЈЙ§МЦЫуЃЌ2molввДМгызуСПФЦЗДгІЩњГЩ1molЧтЦјЃЌЫЕУї1molввДМЗжзгжаДцдк1molЛюЦУЧтдзгЃЛ
ЃЌЫЕУї1molввДМЗжзгжаДцдк1molЛюЦУЧтдзгЃЌЙЪД№АИЮЊЃКЭЈЙ§МЦЫуЃЌ2molввДМгызуСПФЦЗДгІЩњГЩ1molЧтЦјЃЌЫЕУї1molввДМЗжзгжаДцдк1molЛюЦУЧтдзгЃЛ
(3)ЖдБШ2Na + 2H2O=2NaOH + H2ЁќКЭ2CH3CH2OH+2NaЁњ2CH3CH2ONa + H2ЁќПЩжЊЃЌШєЪЙгУЕФввДМжаКЌгаЩйСПЕФЫЎЃЌЗХГіЕФЧтЦјЦЋЖрЃЌдђЪеМЏЕНЧтЦјЕФЬхЛ§ЦЋДѓЃЌЙЪД№АИЮЊЃКЦЋДѓЃЛ
(4)ИљОнЭМЪОЃЌзАжУAЪЧЩњГЩбѕЦјЕФзАжУЃЌЫЋбѕЫЎдкЖўбѕЛЏУЬДпЛЏзїгУЯТЗжНтЗХГібѕЦјЃЌвђДЫзАжУAдВЕзЩеЦПФкЕФЙЬЬхЮяжЪЪЧЖўбѕЛЏУЬЃЛввДМвзЛгЗЂЃЌCжаШШЫЎПЩвддЄШШЗДгІЛьКЯЦјЬхЃЌВЂВњЩњввДМеєЦјЃЌЙЪД№АИЮЊЃКMnO2ЃЛдЄШШЗДгІЛьКЯЦјЬхЃЛ
(5)ЭДпЛЏбѕЛЏввДМЃЌЪЕМЪЩЯАќРЈСНИіЙ§ГЬЃЌвЛИіЪЧЭгыбѕЦјЗДгІЃЌвЛИіЪЧбѕЛЏЭбѕЛЏввДМЃЌвђДЫЪЕбщЙ§ГЬжаDзАжУПЩвдПДЕНЭЗлвЛЛсЖљБфКкЃЌвЛЛсЖљБфССЁЃDДІЗЂЩњЗДгІЕФзмЗНГЬЪНЮЊ2CH3CH2OHЃЋO2![]() 2CH3CHOЃЋ2H2OЃЛИУЗДгІЮЊЗХШШЗДгІЃЌЪЕбщНјаавЛЖЮЪБМфКѓЃЌШчЙћГЗШЅDДІОЦОЋЕЦЃЌЗДгІФмМЬајНјааЃЌЙЪД№АИЮЊЃКССЁЊКкНЛЬцГіЯжЃЛ2CH3CH2OHЃЋO2
2CH3CHOЃЋ2H2OЃЛИУЗДгІЮЊЗХШШЗДгІЃЌЪЕбщНјаавЛЖЮЪБМфКѓЃЌШчЙћГЗШЅDДІОЦОЋЕЦЃЌЗДгІФмМЬајНјааЃЌЙЪД№АИЮЊЃКССЁЊКкНЛЬцГіЯжЃЛ2CH3CH2OHЃЋO2![]() 2CH3CHOЃЋ2H2OЃЛФмЃЛИУЗДгІБОЩэЗХШШЃЛ
2CH3CHOЃЋ2H2OЃЛФмЃЛИУЗДгІБОЩэЗХШШЃЛ
(6)EжаЮЊввШЉЕФЫЎШмвКЃЌЦфжаПЩФмКЌгаввДМЃЌвђДЫМьбщEжаЕФЩњГЩЮяЕФЗНЗЈЮЊЃКдкНрОЛЪдЙмжаМгШыаТжЦЧтбѕЛЏЭаќзЧвКЃЌМгШыEжаШмвКЃЌМгШШжѓЗаЃЌЪдЙмжаГіЯжзЉКьЩЋГСЕэЃЌЫЕУїЩњГЩСЫввШЉЃЌЙЪД№АИЮЊЃКдкНрОЛЪдЙмжаМгШыаТжЦЧтбѕЛЏЭаќзЧвКЃЌМгШыEжаШмвКЃЌМгШШжѓЗаЃЌЪдЙмжаГіЯжзЉКьЩЋГСЕэЃЌЫЕУїЩњГЩСЫввШЉЁЃ

 гІгУЬтзївЕБОЯЕСаД№АИ
гІгУЬтзївЕБОЯЕСаД№АИ