题目内容
【题目】【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:
(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
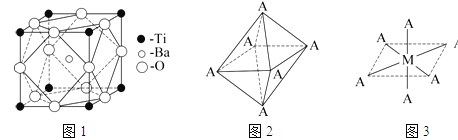
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
【答案】(1)四 IVB 1s22s22p63s23p63d24s2或[Ar]3d24s2
(2)BaTiO36 12
(3)共价 分子 HC1
(4)2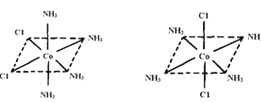
【解析】试题分析:
(1)根据元素周期表可知Ti元素位于元素周期表的第四周期第ⅣB族,Ti元素是22号元素,根据核外电子排布规律可知,它的基态原子的电子层排布式为:1s22s22p63s23p63d24s2或[Ar]3d24s2;
(2)在每个晶胞中均有一个Ba原子,四个Ti原子被四个晶胞共用,每个晶胞中只有一个Ti,12个O原子均被四个晶胞共用,每个晶胞中含有3个O原子,故化学式为BaTiO3,Ti4+的氧配位数为![]() =6,Ba2+的氧配位数为12:
=6,Ba2+的氧配位数为12:
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,熔沸点较低,晶体由分子形成,属于分子晶体,分子由共价键形成,TiCl4在潮湿空气中易挥发,水解而冒白烟,有HCl生成:
(4)Co3+位于正八面体的中心,NH3和Cl-位于正八面体顶点,当两个Cl-相邻时为一种结构,两个Cl-不相邻时为另一种结构,共有两种结构,即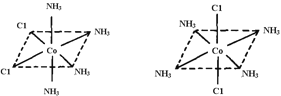 。
。