题目内容
【题目】下列说法正确的是
A. (CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B. 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种(不考虑顺反异构)
C. 1mol有机物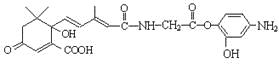 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH
D. 1molβ-紫罗兰酮( )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物
【答案】C
【解析】试题分析:A、烯烃的命名中,从离双键最近的碳原子开始编号,其名称为:2,4,4-三甲基-1-戊烯,A错误;B、对称烯烃与不对称分子加成后产物只有1种,所以碳原子数小于或等于8的某单烯烃与HBr反应,其加成产物只有一结构,符合此条件的单烯烃有CH2=CH2、CH3-CH=CH-CH3、CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2,共4种,B错误;C、有机物中的肽键、酯基、羧基、酚羟基等都可以消耗氢氧化钠,酯基是酚羟基和羧基掉水形成的酯基,可以消耗2mol氢氧化钠,其余均消耗1mol氢氧化钠,共消耗5mol氢氧化钠,C正确;D、1mol β-紫罗兰酮与1mol HBr发生加成反应可得到6不同产物,其中1,2加成四种,1,4加成两种,D错误,答案选C。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目



