题目内容
(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
 浓度 浓度时间 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
A.反应在第2 min到第4min时,O2的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
BD
解析试题分析:先由△c÷△t的定义式直接求v(NH3)或v(NO),再由系数比规律间接求v(O2),则v(O2)="0.3mol/L÷2min×5/4=0.1875" mol/(L·min),故A正确;催化剂能加快反应速率,使c(NH3)的消耗速率增大,虽然升温也能加快反应速率,但也能使平衡左移,使c(NH3)增大,故B错误;第4 min时、第8 min时分别达到化学平衡,由于c(H2O)=6c(NO)/4,则平衡常数分别为(0.54×0.756)/(0.34×0.9755)、(0.14×0.156)/(0.74×1.4755),前者大于后者,故C正确;在开始反应的前2 min内,△c(NH3)=0.2mol/L,则消耗0.2mol NH3,设放出的热量为xkJ,所以4/0.2=Q/x,则x=0.05Q,因此该反应的△H仍是-Q kJ·mol-1,故D错误。
考点:考查化学反应速率的计算、影响化学反应速率和化学平衡的因素、化学平衡常数的计算、化学反应的焓变与热量变化等知识。

 名校课堂系列答案
名校课堂系列答案 一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是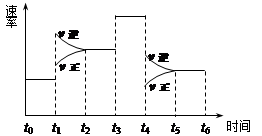
| A.t0→t1 | B.t2→t3 | C.t3→t4 | D.t5→t6 |
常温下,下列溶液中各微粒浓度关系或pH判定不正确的是
| A.将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 |
| B.某物质的溶液中由水电离的c(H+) = 1×10-a mol/L,若a>7,则pH一定为14-a |
| C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>② |
| D.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有: |
二甲醚是一种清洁燃料,以n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)  CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g) +H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
| A.上述反应△H>0 |
| B.图中P1<P2<P3 |
| C.若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) |
| D.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50% |
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g) 4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是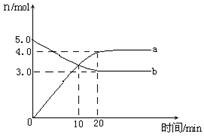
| A.10min时,反应达到平衡 |
| B.达到平衡时N2O5的转化率为60% |
| C.0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应: SO2(g)+NO2(g) SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示。则正确的结论是
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化如图所示。则正确的结论是
| A.逆反应速率:a点小于点c |
| B.反应物浓度:a点小于点b |
| C.反应在c点时SO2的转化率最大 |
| D.反应物的总能量低于生成物的总能量 |
一定温度下的定容容器中,反应A2(g)+B2(g) 2AB(g)达到平衡标志的是 ( )
2AB(g)达到平衡标志的是 ( )
| A.单位时间内生成2n mol AB同时消耗n mol B2 |
| B.单位时间总物质的量不随时间的变化而变化 |
| C.单位时间内生成n mol A2同时消耗n mol B2 |
| D.容器内各组分的物质的量不随时间的变化而变化 |
下列有关化学反应速率的说法中,正确的是 ( )
| A.100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变 |
B.对于可逆反应2CO + 2NO  N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 |
| C.二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 |
| D.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
某反应中,X、Y、Z三种物质的物质的量随时间的变化如图所示。下列说法正确的是
| A.反应为 X + 2Z= Y |
B.反应为 X + Y 2Z 2Z |
| C.4 s 时,反应达到平衡 |
| D.12 s 时,反应不再进行 |