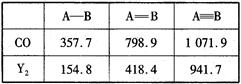
题目内容
试分析下列各种情况下微粒间作用力的变化情况(填“离子键”“极性键”“非极性键”或“分子间作用力”):
①NaCl溶于水时破坏___________________________________;
②HCl溶于水时破坏____________________________________;
③SO2溶于水时破坏____________________________________;
④酒精溶于水时破坏____________________________________;
⑤NaOH和HCl反应时形成_______和_______;
⑥反应2H2+O22H2O中,被破坏的是________,形成的是________;
⑦CaCl2和Na2CO3反应时,被破坏的化学键有________,形成的化学键有________;
⑧Na2O熔化时被破坏的是________。
①离子键 ②极性键 ③极性键 ④分子间作用力 ⑤离子键 极性键 ⑥非极性键 极性键 ⑦离子键 离子键 ⑧离子键
解析

 应用题作业本系列答案
应用题作业本系列答案下列说法正确的是
| A.蛋白质在氧气中完全燃烧转化为水和二氧化碳 |
| B.淀粉和纤维素分子式均可表示成(C6Hl005)n,它们互为同分异构体 |
| C.与碱反应生成盐和水的氧化物均为酸性氧化物 |
| D.离子化合物中可能含有共价键 |
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E; =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A; =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E; =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g); =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率
 ( A2)为 。
( A2)为 。②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。

下列各组物质的晶体中,化学键种类相同,晶体类型也相同的是
| A.MgO和BaO2 | B.SO2和SiO2 | C.KOH和NH4Cl | D.CCl4和KCl |
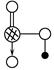 ,请简要说明该物质易溶于水的原因________________________________。
,请简要说明该物质易溶于水的原因________________________________。 ,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。 O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y