题目内容
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;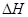 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;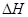 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;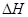 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);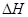 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 | 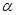 3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率
 ( A2)为 。
( A2)为 。②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
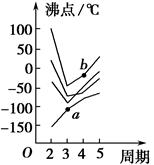
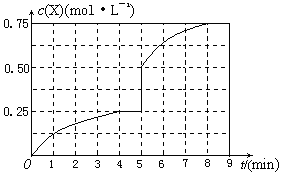
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
(1)离子键、共价键(1分)(1分)
(2)H2(g)+Cl2(g)=2HCl(g);△H=(a+b-2c)kJ·mol-1(2分)
(3)①0.125mol·L-1·min-1(2分) ② 4(2分) ③ C(2分) ④ ABD(2分)
(4) (2分)
(2分)
解析试题分析:A是周期表中原子半径最小的元素,即为H,B是形成化合物种类最多的元素,即为C
,C是自然界含量最多的元素,即为O,D是同周期中金属性最强的元素,即为Na,E的负一价离子与C的某种氢化物分子W含有相同的电子数,由于E的原子序数最大,则E即为Cl,因此W是双氧水。
(1)A、C、D形成的化合物是氢氧化钠,其中含有的化学键类型为:离子键、共价键;双氧水分子中含有极性键和非极性键,属于共价化合物,因此双氧水的电子式为 。
。
(2)已知①Cl-Cl→2Cl;△H=+a kJ?mol-1、②2H→H-H;△H=-b kJ?mol-1、③Cl+H→HCl;△H=-c kJ?mol-1,所以依据盖斯定律可知H2(g)+Cl2(g)=2HCl(g)可以是①-②+③×2得到的,因此反应的焓变△H=-(2c-a-b)kJ/mol。
(3)①2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
初始量:2 1 0
变化量:1 0.5 0.5
平衡量:1 0.5 0.5
在该温度下,A2的平均反应速率v(A2)=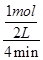 =0.125 mol?L-1?min-1;
=0.125 mol?L-1?min-1;
②化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该温度下,反应2H2(g)+CO(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=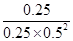 =4mol-2?L2;
=4mol-2?L2;
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则A、平衡时各种物质的浓度或物质的量不再发生变化,但它们之间的物质的量不一定相等或满足某种关系,因此容器内A2、BC、X的物质的量之比为2:1:1不能说明达到平衡状态,A不正确;B、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体的密度保持恒定不能说明反应达到平衡状态,B不正确;C、容器内A2气体的体积分数保持恒定可以说明反应达到平衡状态,C正确;D、2V正(A2)=V逆(BC)说明二者的反应速率方向是相反的,但不能满足反应速率之比是相应的化学计量数之比,不能说明反应达到平衡状态,D不正确,答案选C。
④A、投料2molH2、1molCO和1molCH4O建立的平衡是等效的,只是建立的方向不一样,所以α1+α2=1,故A正确;B、料2molH2、1molCO和1molCH3OH建立的平衡是等效的,反应2H2(g)+CO(g)?CH3OH(g)是放热的,放出的热量应该是Q1+Q2=a,故B正确;C、当氢气和一氧化碳的投料增加一倍,则压强会增大,导致化学平衡正向移动,移动的结果是反应物的转化率增大,即α3>α1,故C错误;D、投料2molH2、1molCO和1molCH3OH建立的平衡是等效的,所以P1=P2,当氢气和一氧化碳的投料增加一倍,则压强应是增大一倍,但是压强增大,导致化学平衡正向移动,移动的结果是压强比原来的2倍要小,即P3<2P1=2P2,故D正确;E、当氢气和一氧化碳的投料增加一倍,能量变化数值理论上也应该是原来的2倍,但是压强引起化学平衡正向,而正向放热,结果使得Q3>2Q1,故E错误。选ABD。
(4)将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,则
2H2(g)+CO(g) CH4O(g)
CH4O(g)
初始量:2 1 0
变化量:1.5 0.75 0.75
平衡量:0.5 0.25 0.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示: 。
。
考点:考查元素推断、化学键、电子式、热化学方程式、反应速率与平衡常数的计算、外界条件对平衡状态的影响以及平衡状态的判断鞥

 阅读快车系列答案
阅读快车系列答案化学键是相邻原子间强烈的相互作用,主要有离子键、共价键等。有关它们叙述正确的是
| A.非金属元素组成的化合物中只含共价键 |
| B.不同元素的原子构成的分子只含极性共价键 |
| C.熔融状态下能够导电的化合物中存在离子键 |
| D.单质分子中均存在化学键 |
下列叙述正确的是
| A.非金属原子间以共价键结合的物质一定是共价化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.凡是能电离出离子的化合物一定是离子化合物 |
| D.凡是含有离子键的化合物一定是离子化合物 |
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了 。

(2)ACl2分子中A的杂化类型为 。
(3)我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,其中SO42-的空间构型是 (用文字描述),与NO3-互为等电子体的分子是 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质的K原子和C60分子的个数比为 。

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
| A.熔融态不导电 | B.水溶液呈中性 |
| C.熔点比BeBr2高 | D.不与氢氧化钠溶液反应 |