题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的还原产物是______;
(2)该反应的平衡常数表达式为K=____________;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”);若已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,则N2消耗速率为
(CO)=18molL﹣1min﹣1,则N2消耗速率为![]() (N2)=_________;
(N2)=_________;
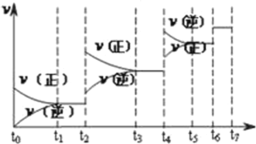
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
与时间t的关系如图,图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中CO的含量最高的一段时间是__________。
【答案】Si3N4 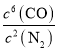 < 减小 6 molL﹣1min﹣1 升高温度或增大压强 t3-t4
< 减小 6 molL﹣1min﹣1 升高温度或增大压强 t3-t4
【解析】
(1) 反应中N元素的化合价降低,由0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,还原产物为Si3N4;
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K=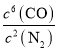 ;
;
(3) 该反应为放热反应,△H<0;升高温度平衡向逆反应方向移动,则平衡常数减小,速率之比等于化学计量数之比,则![]() ,已知CO生成速率为
,已知CO生成速率为![]() (CO)=18molL﹣1min﹣1,
(CO)=18molL﹣1min﹣1,![]() (N2)= 6molL﹣1min﹣1;
(N2)= 6molL﹣1min﹣1;
(4) t4时正逆反应速率都较原平衡时的速率大,且平衡向逆反应方向移动,可升高温度或增大压强;t2~t3平衡正向移动,t3~t4保持平衡状态,在t4~t5反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高;
故答案为:升高温度或增大压强;t3~t4。

【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)铁晶体有两种晶胞,如图1、图2所示。
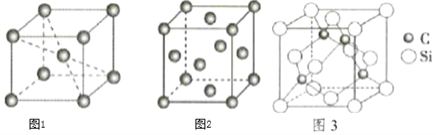
图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
【题目】下表列出了①~⑨九种元素在周期表中的位置,A、B和C是中学常见的化合物,回答问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)上述所列元素中,最高价氧化物的水化物的酸性最强的是________(填化学式)。
(2)②元素最高正价与④元素形成的化合物的电子式是__________。
(3)⑤⑨两种元素形成氢化物的水溶液的酸性由弱到强的顺序为________(用化学式表示)。
(4)从④⑥两种元素形成的化合物与④⑧两种元素形成的化合物的混合物中分离提纯④⑧两种元素形成的化合物,可加入上表中________(用元素符号表示)两种元素形成的化合物的水溶液后,再过滤洗涤。
(5)③元素的气态氢化物与其最高价氧化物的水化物反应生成的物质为________(用化学式表示),该物质所含化学键类型有________________。