题目内容
【题目】a、b、c、d、e、f是原子序数依次增大的前四周期元素,a的基态原子有3个不同的能级,且各能级中电子数相等;c的基态原子最外层电子数是其内层电子数的三倍;b、d、f同主族;e的基态原子内层轨道全部排满电子,且最外层电子数为1。
(1)基态f原子的电子占据最高的能层符号为________,该能层的电子排布式为________。
(2)如图为部分主族元素第一电离能与周期数的关系图,若m点为氢元素,则元素c为点________(填字母序号)。
(3)ac2中σ键和π键之比为________,写出一种与ac2具有相同空间构型和键合形式的分子________。

(4)dCl5是一种白色晶体,其熔体可以导电,测得其中只含有一种正四面体形阳离子和一种正八面体形阴离子,其中阳离子中d原子的杂化轨道类型为________。试用电离方程式解释dCl5熔体能导电的原因:___________________________________________。
(5)已知单质e的堆积方式如图所示,该堆积模型的名称为________,该晶胞中空间利用率为________(列出含“π”的计算式)。

【答案】 N 4s24p3 p 1∶1 CS2 sp3 2PCl5=PCl4++PCl6- 面心立方最密堆积 )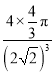 ×100%
×100%
【解析】a、b、c、d、e、f是原子序数依次增大的前四周期元素,a的基态原子有3个不同的能级,且各能级中电子数相等,则a的电子排布式为1s22s22p2,为C元素;c的基态原子最外层电子数是其内层电子数的三倍,c为O元素;则b为N元素;b、d、f同主族,则d为P元素,f为As元素;e的基态原子内层轨道全部排满电子,且最外层电子数为1,e的价层电子排布式为3d104s1,为Cu元素。
(1)f为As元素;基态f原子的电子占据最高的能层符号为N,该能层的电子排布式为4s24p3,故答案为:N;4s24p3;
(2)c为O元素;同一周期元素中,元素第一电离能随着原子序数的增大而呈增大趋势,但是第IIA族的第一电离能大于相邻第ⅢA族,第ⅤA族的第一电离能大于相邻第ⅥA族,所以m是N,p是O元素,故答案为:p;
(3)ac2为CO2,σ键和π键之比为2:2=1:1,与ac2具有相同空间构型和键合形式的分子可以是CS2,故答案为:1∶1;CS2;
(4)测得PCl5是一种白色晶体,其熔体可以导电,其中只含有一种正四面体形阳离子和一种正八面体形阴离子,其中阳离子为PCl4+中P原子的杂化轨道类型为sp3;正八面体形阴离子为PCl6-,电离方程式为2PCl5=PCl4++PCl6-,故答案为:sp3;2PCl5=PCl4++PCl6-;
(5)根据铜的堆积方式可知,该堆积模型为面心立方最密堆积;若铜原子的半径为r,则晶胞棱长为4r×![]() =2
=2![]() r,则晶胞体积为(2
r,则晶胞体积为(2![]() r)3,晶胞中H原子数目为8×
r)3,晶胞中H原子数目为8×![]() +6×
+6×![]() =4,晶胞中Q原子占有的总体积为4×
=4,晶胞中Q原子占有的总体积为4×![]() πr3,晶胞中原子的空间利用率=4×
πr3,晶胞中原子的空间利用率=4×![]() πr3÷(2
πr3÷(2![]() r)3×100%=
r)3×100%=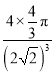 ×100%,故答案为:面心立方最密堆积;
×100%,故答案为:面心立方最密堆积; 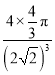 ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案
