题目内容
14.用2-丙醇为有机原料制取1,2-丙二醇,其各步反应所属的反应类型是( )| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→还原 |
分析 由2-丙醇为原料制取1,2-丙二醇,由逆合成法可知,1,2-丙二醇→1,2-二卤丙烷→丙烯→2-丙醇,以此来解答.
解答 解:2-丙醇为原料制取1,2-丙二醇,则
①2-丙醇发生消去反应生成丙烯,
②丙烯与溴水发生加成反应生成1,2-二溴丙烷,
③1,2-二溴丙烷发生水解反应生成1,2-丙二醇,为取代反应(水解),
即需要经过的反应类型为消去-加成-取代(水解),
故选B.
点评 本题考查有机物的合成,为高频考点,把握合成中官能团的变化及逆合成分析法为解答的关键,侧重醇、烯烃、卤代烃性质的考查,题目难度不大.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
5.室温下,向含有溶质为0.10mol的下列溶液中通入0.10mol的相应的气体(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向NH4HCO3溶液中通入CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| B. | 向Na2SO3溶液通入SO2:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 向CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| D. | 向NH4Cl溶液中通入NH3:c(NH4+)<c(Cl-) |
2.下列关于实验的叙述中正确的有 ( )
| A. | 不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火 | |
| B. | 不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗 | |
| C. | 用托盘天平称量物品质量时,物品应置于右盘 | |
| D. | 实验时应节约药品,实验剩余的药品应放回原试剂瓶 | |
| E. | 可燃性气体点燃前一定要验纯 | |
| F. | 可燃性气体点燃前一定要验纯 |
19.相同质量的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,二者比较,相等的是( )
①铜片消耗完所需时间 ②反应中氧化剂得到电子的总数
③反应生成气体的体积(同温、同压) ④反应后溶液中铜离子浓度.
①铜片消耗完所需时间 ②反应中氧化剂得到电子的总数
③反应生成气体的体积(同温、同压) ④反应后溶液中铜离子浓度.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
4.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO${\;}_{4}^{2-}$、Br-、CO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
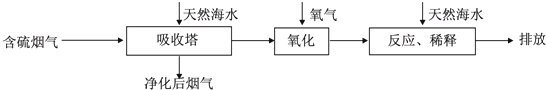
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2=2H2SO4.
氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,p≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入B (填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9mol•L-1,是否符合排放标准是 (填“是”或“否”).已知KSP(AgCl)=1.8×l-10mol2•L2.
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2=2H2SO4.
氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,p≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9mol•L-1,是否符合排放标准是 (填“是”或“否”).已知KSP(AgCl)=1.8×l-10mol2•L2.

 水的电离平衡如图所示.
水的电离平衡如图所示.