题目内容
5.室温下,向含有溶质为0.10mol的下列溶液中通入0.10mol的相应的气体(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )| A. | 向NH4HCO3溶液中通入CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| B. | 向Na2SO3溶液通入SO2:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 向CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| D. | 向NH4Cl溶液中通入NH3:c(NH4+)<c(Cl-) |
分析 A.碳酸氢铵溶液中通入二氧化碳气体后,二氧化碳与水反应生成碳酸,碳酸电离出大量碳酸氢根离子,则c(NH4+)<c(HCO3-)+c(CO32-);
B.反应生成亚硫酸氢钠,关键亚硫酸氢钠溶液中的物料守恒判断;
C.反应生成等浓度的醋酸和氯化钠,醋酸部分电离,则c(Na+)=c(Cl-)>c(CH3COOH);
D.反应后溶质为等浓度的氯化铵和一水合氨,溶液显示碱性,根据电荷守恒判断离子浓度大小.
解答 解:A.NH4HCO3溶液中通入CO2,二氧化碳与水反应生成的碳酸能够电离出碳酸氢根离子,导致碳酸氢根离子浓度最大,则c(NH4+)<c(HCO3-)+c(CO32-),故A错误;
B.向含有0.1molNa2SO3溶液通入0.1molSO2,恰好反应生成亚硫酸氢钠,根据亚硫酸氢钠溶液中的物料守恒可知:c(Na+)═[c(SO32-)+c(HSO3-)+c(H2SO3)],故B正确;
C.向含有0.1molCH3COONa溶液中通入0.1molHCl,反应生成0.1mol醋酸和0.1molNaCl,钠离子和氯离子不水解,醋酸在溶液中部分电离,则c(Na+)=c(Cl-)>c(CH3COOH),故C错误;
D.含有0.1molNH4Cl溶液中通入0.1molNH3,铵根离子的水解程度小于一水合氨的电离程度,混合液显示碱性,则c(H+)<c(OH-),根据电荷守恒可知:c(NH4+)>c(Cl-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成及盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.目前,消除氮氧化物污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
①不能作为判断反应达到化学平衡状态的依据是BC
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小二氧化碳浓度.
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2 (s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s),该电池正极的电极反应式是2MnO2+2e-+H2O=2OH-+Mn2O3.PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生反应的电极反应式为Pb2++2H2O-2e-=PbO2+4H+,阴极上观察到的现象是;石墨上红色物质析出若电解液中不加入Cu(NO3)2这样做的主要缺点是Pb将在阴极析出,Pb2+不能得到有效应用.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小二氧化碳浓度.
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2 (s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s),该电池正极的电极反应式是2MnO2+2e-+H2O=2OH-+Mn2O3.PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生反应的电极反应式为Pb2++2H2O-2e-=PbO2+4H+,阴极上观察到的现象是;石墨上红色物质析出若电解液中不加入Cu(NO3)2这样做的主要缺点是Pb将在阴极析出,Pb2+不能得到有效应用.
13.将一定量的A和B加入密闭容器中,在一定条件下发生反应:A(g)+B(s)?2C(g).忽略固体的体积,平衡时A的体积分数(%)随温度和压强的变化如下表所示:
回答下列问题:
(1)欲提高C的产率,应采取的措施为升高温度、降低压强;
(2)该反应△H> 0(填“<”或“>”);
(3)比较K(810℃)< K(915℃) (填“<”、“>”或“=”),说明理由升高温度平衡向正向移动,因此平衡常数增大;
(4)915℃2.0MP时A的转化率为60%;
(5)比较b>f(填“<”、“>”或“=”),说明理由升温平衡正向移动所以f<25.0<a,增大压强平衡逆向移动所以a<b,所以b>f;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K=0.133(保留两位有效数字).
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 46.0 | a | b |
| 915 | c | 25.0 | d |
| 1000 | e | f | 15.0 |
(1)欲提高C的产率,应采取的措施为升高温度、降低压强;
(2)该反应△H> 0(填“<”或“>”);
(3)比较K(810℃)< K(915℃) (填“<”、“>”或“=”),说明理由升高温度平衡向正向移动,因此平衡常数增大;
(4)915℃2.0MP时A的转化率为60%;
(5)比较b>f(填“<”、“>”或“=”),说明理由升温平衡正向移动所以f<25.0<a,增大压强平衡逆向移动所以a<b,所以b>f;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K=0.133(保留两位有效数字).
10.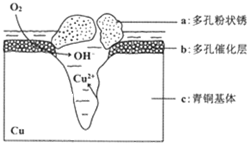 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )| A. | 腐蚀过程中,负极是a | |
| B. | 正极反应是 O2+4e-+2H2O═4OH- | |
| C. | 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) | |
| D. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ |
17.如表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题.
(1)⑥表示的元素是氯或Cl;
(2)②的原子结构示意图是 ;
;
(3)由①和③两种元素组成的化合物的化学式是NH3;
(4)④和⑤两种元素的金属性强弱顺序是④> ⑤(填“<”或“>”).
(5)④的最高价氧化物对应的水化物与A1(0H)3反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
| 族 周期 | IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
(2)②的原子结构示意图是
 ;
;(3)由①和③两种元素组成的化合物的化学式是NH3;
(4)④和⑤两种元素的金属性强弱顺序是④> ⑤(填“<”或“>”).
(5)④的最高价氧化物对应的水化物与A1(0H)3反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
14.用2-丙醇为有机原料制取1,2-丙二醇,其各步反应所属的反应类型是( )
| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→还原 |
15.下列各组的两种物质在溶液中反应,可用同一离子方程式表示的是( )
| A. | 氢氧化铜与盐酸、氢氧化钡与盐酸 | |
| B. | 石灰石和硝酸溶液、石灰石与盐酸溶液 | |
| C. | BaCO3与HCl溶液、Na2CO3溶液NaHSO4 | |
| D. | 石灰水中通CO2、石灰水中通SO2 |