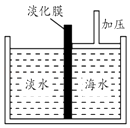
��Ŀ����
����Ŀ����NA��ʾ����٤��������������Ȼ�ѧ����ʽ��C2H2��g��+ ![]() O2��g���T2CO2��g��+H2O��l����H=��1300kJmol��1��˵���У���ȷ���ǣ�������
O2��g���T2CO2��g��+H2O��l����H=��1300kJmol��1��˵���У���ȷ���ǣ�������
A.����6 NA������ת��ʱ���÷�Ӧ�ų�1300 kJ������
B.����NA��ˮ����������ΪҺ��ʱ������1300 kJ������
C.����4NA��̼�����õ��Ӷ�����ʱ���ų�1300 kJ������
D.����8NA��̼�����õ��Ӷ�����ʱ���ų�1300 kJ������
���𰸡�D
���������⣺A����Ӧ��CԪ�ػ��ϼ��ɩ�1�����ߵ�+4�ۣ���ÿ��1 mol C2H2�μӷ�Ӧ��ת��10 mol���ӣ��ų�1 300 kJ��������A����
B����ӦΪ���ȷ�Ӧ����B����
C������4NA��̼�����õ��Ӷ�����ʱ������1mol������̼���ų�650kJ����������C����
D.1 mol CO2�����к���4 mol̼�����õ��Ӷԣ���8NA��̼�����õ��Ӷ�����ʱ����������2 mol CO2���ų�1 300 kJ����������D��ȷ��
��ѡD��
�����㾫�������÷�Ӧ�Ⱥ��ʱ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�

��ϰ��ϵ�д�
 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
�����Ŀ