题目内容
现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。
①A、B、C是非金属元素,A是原子半径最小元素;元素B的原子最外层电子数是内层电子数的2倍。
②A、C两元素可形成原子比2∶1和1∶1两种常温下为液态的化合物。
③D、E是同周期的金属元素,D单质在C单质燃烧时发出黄色火焰,生成化学式为D2C2的离子化合物。
④A、C、D三元素化合物与A、C、E三元素化合物在溶液中反应生成盐和水。
请回答下列问题:
(1)B元素的名称是 ,C在元素周期表中的位置是 。
(2)C、D、E三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是 (用元素符号表示)。
(3)A与B、A与C元素之间均能形成10电子共价化合物,此两种化合物中沸点高得多的是(写化学式) ,主要原因是 。
(4)写出④的离子方程式 。
①A、B、C是非金属元素,A是原子半径最小元素;元素B的原子最外层电子数是内层电子数的2倍。
②A、C两元素可形成原子比2∶1和1∶1两种常温下为液态的化合物。
③D、E是同周期的金属元素,D单质在C单质燃烧时发出黄色火焰,生成化学式为D2C2的离子化合物。
④A、C、D三元素化合物与A、C、E三元素化合物在溶液中反应生成盐和水。
请回答下列问题:
(1)B元素的名称是 ,C在元素周期表中的位置是 。
(2)C、D、E三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是 (用元素符号表示)。
(3)A与B、A与C元素之间均能形成10电子共价化合物,此两种化合物中沸点高得多的是(写化学式) ,主要原因是 。
(4)写出④的离子方程式 。

(1)碳 第二周期Ⅵ A族 (2)O2->Na+>Al3+
(3)H2O 液态水中存在氢键 (4)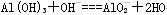
(3)H2O 液态水中存在氢键 (4)
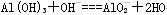
本题考查元素推断,中等题。(1)根据①,A为H,B为C;根据②,可以推断两种化合物为H2O、H2O2,因此C为O;根据③,可以推断D为Na;根据④,可以判断E的氢氧化物能与NaOH反应,因此E为Al。(2)根据相同电子层结构的粒子,核电荷数越大,粒子半径越小进行判断。(3)H2O分子间存在氢键,其沸点比CH4高。(4)反应④为NaOH和Al(OH)3的反应。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目