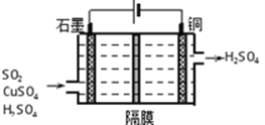
题目内容
【题目】下列说法中正确的是
A.HF、HCl、H2S、PH3的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D.在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
【答案】D
【解析】
A.非金属性:F>Cl>S>P,故稳定性:HF>HCl>H2S>PH3,即HF、HCl、H2S、PH3的稳定性依次减弱,A错误;
B.N、F位于第二周期,Mg、Si位于第三周期,Mg、Si原子半径比N、F原子半径大,同周期元素从左往右,原子半径增大,故原子半径:Mg>Si>N>F,即按Mg、Si、N、F的顺序,原子半径由大变小,B错误;
C.第四电离能突然增大,说明该元素原子最外层有3个电子,则该元素位于第ⅢA族,C错误;
D.P和S位于同一周期相邻位置,P的3p轨道为半充满状态,较稳定,难失电子,故P的第一电离能大于S。Mg、Ca位于同主族相邻位置,Mg的原子半径较小,失电子能力小于Ca,故第一电离能大于Ca。Al和Si位于同一周期相邻位置,Al的原子半径较大,失电子能力较强,故第一电离能小于Si,即①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素分别是P、Mg、Si,三者的原子序数之和=15+12+14=41,D正确。
答案选D。

练习册系列答案
相关题目