题目内容
(13分)已知:
① N2 (g) + 2O2 (g) = 2NO2 (g) △H1 = + 67.7kJ/mol
②N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H2 = -534kJ/mol
③1/2H2 (g) + 1/2F2 (g) = HF (g) △H3 = -269kJ/mol
④H2 (g) + 1/2O2 (g) = H2O (g) △H4 = -242kJ/mol
⑤H2O(l)====H2O(g) △H5=+44kJ·mol-1
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出液态肼和足量H2O2反应的热化学方程式_______________________________。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(3)16 g气态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(4根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______________ ______________________。
(5)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
(1)N2H4(l)+2 H2O2 (l) === N2(g)+ 4 H2O (g) △H= - 641.625 kJ·mol-1
(2)优点是生成N2和H2O,对环境无污染
(3)放出的热量是311 kJ。
(4)2N2H4(g)+2 NO2 (g) === 3N2(g)+4 H2O(g);△H= - 1135.7kJ·mol-1
(5)N2H4 (g) +2 F2 (g) = N2(g) +4HF (g) △H = -1126 kJ/mol
【解析】(1)考查热化学方程式的书写。0.4mol液态肼燃烧放出256.65kJ的热量,则1mol燃烧放出的热量是256.65kJ×2.5=641.625 kJ,因此热化学方程式为N2H4(l)+2 H2O2 (l) === N2(g)+ 4 H2O (g) △H= - 641.625 kJ·mol-1。
(2)根据燃烧产物水和氮气可知,生成物对环境没有污染。
(3)根据反应②可知16 g气态肼燃烧生成氮气和气态水时,放出的热量是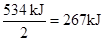 。生成物1mol气态水生成液态时,放出的热量是44kJ,所以16 g气态肼燃烧生成氮气和液态水时,放出的热量是267kJ+44kJ=311 kJ。
。生成物1mol气态水生成液态时,放出的热量是44kJ,所以16 g气态肼燃烧生成氮气和液态水时,放出的热量是267kJ+44kJ=311 kJ。
(4)②×2-①即得到2N2H4(g)+2 NO2 (g) === 3N2(g)+4 H2O(g);△H= - 1135.7kJ·mol-1。
(5)根据盖斯定律可知③×4+②-④×2即得到N2H4 (g) +2 F2 (g) = N2(g) +4HF (g) △H = -1126 kJ/mol。

请回答:
(1)“氯盐类”融雪剂主要成分的晶体类型为
(2)冰比硫化氢熔点高的原因是
类型为
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)已知CN-与 N2结构相似,1mol CN-中π键数目为

 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=