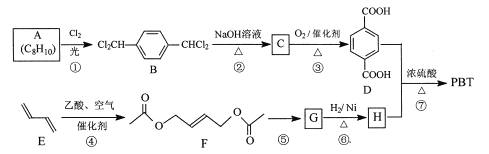
题目内容
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
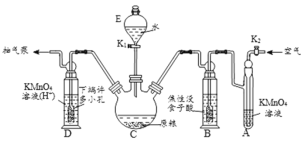
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100g原粮,D中盛有20.00mL1.12×10-4molL-1KMnO4溶液(H2SO4酸化)。
请回答下列问题:
(1)仪器E的名称是___,该仪器可否用于分液操作___?(答“能”或“不能”)
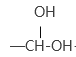
(2)以磷化钙为例,写出磷化钙与水反应除了生成PH3之外,另一产物的电子式是___;检查整套装置气密性的方法是关闭___打开___,抽气泵缓慢抽气,若观察到___(填字母)装置中有气泡产生则气密性良好。
(3)A中盛装KMnO4溶液的作用是___;通入空气的作用是___。焦性没食子酸可以吸收氧化性气体,若没有B装置,则实验中测得PH3含量将___(填“偏低”、“偏高”或“不变”)
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为___。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5molL-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为___ mgkg-1。
【答案】分液漏斗 不能 ![]() K1 K2 ABD 除去空气中的还原性气体 吹出PH3,使其全部被酸性KMnO4溶液吸收 偏低 5PH3+8MnO
K1 K2 ABD 除去空气中的还原性气体 吹出PH3,使其全部被酸性KMnO4溶液吸收 偏低 5PH3+8MnO![]() +24H+==5H3PO4+8Mn2++12H2O 0.0085
+24H+==5H3PO4+8Mn2++12H2O 0.0085
【解析】
根据题干信息可知,安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定,已知C中盛有100g原粮,E中盛有20.00mL1.13×10-3molL-1KMnO4溶液(H2SO4酸化),吸收生成的PH3,B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3,A中盛装KMnO4溶液的作用除去空气中的还原性气体,据此分析解答。
(1)由E的结构可知,E为球形分液漏斗;梨形分液漏斗下端小,萃取完成以后分液时较容易,球形分液漏斗不能用于分液操作;
(2)磷化钙与水反应生成氢氧化钙和磷化氢,Ca3P2+6H2O=3Ca(OH)2+2PH3↑,另一产物氢氧化钙的电子式为![]() ,检查装置气密性的方法是关闭K1打开K2,抽气泵缓慢抽气,若观察到ABD装置中有气泡产生则说明装置气密性良好;
,检查装置气密性的方法是关闭K1打开K2,抽气泵缓慢抽气,若观察到ABD装置中有气泡产生则说明装置气密性良好;
(3)依据装置图进行分析判断,高锰酸钾溶液是强氧化剂,可以吸收空气中的还原性气体;通入空气,吹出PH3,使其全部被酸性KMnO4溶液吸收,减小实验误差;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的氧气,防止氧化装置C中生成的PH3,若没有B装置,PH3部分被氧气氧化,则实验中测得PH3含量将偏低;
(4)PH3被酸性高锰酸钾氧化成磷酸,高锰酸钾被还原为锰离子,结合电子守恒和电荷守恒、原子守恒配平书写得到离子方程式为:5PH3+8MnO![]() +24H+==5H3PO4+8Mn2++12H2O;
+24H+==5H3PO4+8Mn2++12H2O;
(5)根据2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O反应可知,25毫升溶液中剩余KMnO4的量为[5.0×10-5×11×10-3]×![]() =2.2×10-7mol;那么250毫升溶液中剩余KMnO4的量为
=2.2×10-7mol;那么250毫升溶液中剩余KMnO4的量为![]() ×2.2×10-7mol=2.2×10-6mol;与PH3反应的高锰酸钾物质的量=20×1.12×10-4×10-3mol-2.2×10-6mol=4.0×10-8mol,根据5PH3+8MnO
×2.2×10-7mol=2.2×10-6mol;与PH3反应的高锰酸钾物质的量=20×1.12×10-4×10-3mol-2.2×10-6mol=4.0×10-8mol,根据5PH3+8MnO![]() +24H+==5H3PO4+8Mn2++12H2O反应关系可知,消耗PH3的量为[4×10-8]×
+24H+==5H3PO4+8Mn2++12H2O反应关系可知,消耗PH3的量为[4×10-8]×![]() mol;C中盛100g原粮,含有PH3的量[4×10-8]×
mol;C中盛100g原粮,含有PH3的量[4×10-8]×![]() mol,质量为85×10-8g,则该原粮中磷化物(以PH3计)的含量为0.0085mgkg-1。
mol,质量为85×10-8g,则该原粮中磷化物(以PH3计)的含量为0.0085mgkg-1。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案