题目内容
6.在1.00L1.00mol/LNaOH溶液中通入16.8L标准情况下的CO2计算所得溶液中含有的NaHCO3和Na2CO3的物质的量.分析 n(CO2)=$\frac{16.8L}{22.4L/mol}$=0.75mol,n(NaOH)=1mol/L×1L=1mol,再利用Na原子、C原子守恒列方程式组进行计算.
解答 解:n(CO2)=$\frac{16.8L}{22.4L/mol}$=0.75mol,n(NaOH)=1mol/L×1L=1mol,
设NaHCO3和Na2CO3的物质的量分别是xmol、ymol,由Na原子、C原子守恒可得:
$\left\{\begin{array}{l}{x+y=0.75}\\{x+2y=1}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.5}\\{y=0.25}\end{array}\right.$,
答:溶液中含有NaHCO3和Na2CO3的物质的量分别是0.5mol、0.25mol.
点评 本题考查混合物计算、化学方程式计算,侧重考查分析计算能力,注意利用原子守恒解答,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
16.下列化学方程式中,能用离子方程式SO42-+Ba2+═BaSO4↓来表示的是( )
| A. | BaCO3+H2SO4═BaSO4↓+H2O+CO2↑ | B. | BaCl2+Na2CO3═BaCO3↓+2NaCl | ||
| C. | BaCl2+Na2SO4═BaSO4↓+2NaCl | D. | Ba(OH)2+CuSO4═Cu(OH)2↓+BaSO4↓ |
8.现有室温下的四种溶液,其pH如表所示,下列有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ②③两溶液等体积混合,所得溶液中:c(OH-)>c(H+) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L④和V2L①溶液混合后,若pH=7,则V1<V2 |
9.下列说法正确的是( )
| A. | c(H+)=c(OH-)的溶液一定呈中性 | |
| B. | 常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH>7 | |
| D. | 0.1 mol•L-1Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
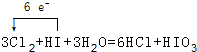 .
. (1)氨在国民经济中占有重要地位.
(1)氨在国民经济中占有重要地位.
 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1