题目内容
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是 。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 ,B可能是 。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是 L,质量是 g。
(1)XY3 (2)N2(或CO或C2H4) H2 (3)11.2 14
解析

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案在硫酸、明矾和硫酸铝组成的混合溶液中,c(Al3+)="0.3" mol·L-1,c(SO42-)=0.7mol·L-1, 由水电离的c(H+)=10-13 mol·L-1,则c(K+)为
| A.0.15mol·L-1 | B.0.2mol·L-1 | C.0.3mol·L-1 | D.0.4mol·L-1 |
设NA为阿伏伽德罗常数的值。下列叙述正确的是
| A.1 mol Cl2发生反应时,转移的电子数一定是2NA |
| B.标准状况下,22.4L H2O中所含氢原子数目为2NA |
| C.1.0 L的 0.1 mol·L-1Na2CO3溶液中含有的CO32-数目为0.1NA |
| D.7.8 g 过氧化钠(Na2O2)固体中阴、阳离子总数为0.3NA |
下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程: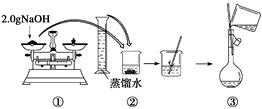
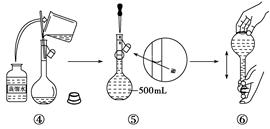
该同学的错误步骤有( )
| A.1处 | B.2处 | C.3处 | D.4处 |
下列微粒中,对水的电离平衡不产生影响的是( )
A.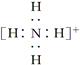 | B. | C.26R3+ | D.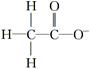 |
把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.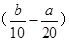 mol/L mol/L | B.(2b-a)mol/L | C.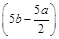 mol/L mol/L | D.(10b-5a)mol/L |
设NA为阿伏加德罗常数的值,下列法说中正确的是( )
| A.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA |
| B.标准状况下,2.24 L Cl2与足量的H2O反应,转移的电子总数为0.1 NA |
| C.标准状况下,22.4 L甲醇(CH3OH)中含有的氧原子数为1.0 NA |
| D.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 |
标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是( )
| A.所得沉淀为0.05 mol的BaSO4 |
| B.混合气体中SO2的体积为0.448 L |
| C.a L混合气体的物质的量为0.04 mol |
| D.a的取值范围为0.672<a<0.896 |
 ×100%
×100%