题目内容
【题目】I. 已知4℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(液) | 170g | 9.2g | 1.5×10-4g | 33. 3g |
NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为_____________________,在液氨中形成复分解反应的化学方程式为______________________________。
II. 现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦ 红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH-![]() H2O,该离子反应对应的化学方程式为 _____________________________________________
H2O,该离子反应对应的化学方程式为 _____________________________________________
(2)⑩在水中的电离方程式为 ____________________________________
(3)少量的④通入⑥的溶液中反应的离子方程式为_____________________________
过量的④通入⑥的溶液中反应的离子方程式为_______________________________
(4)⑥与过量的碳酸氢钠溶液反应离子方程式:_________________________________
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
用双线桥标明电子转移的方向和数目__________________________________________,
当有5.4g Al发生反应时,转移电子的数目为 ____________ 。
【答案】Ag++Cl-=AgCl↓ Ba(NO3)2+2AgCl= BaCl2↓+2AgNO3 Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Al2(SO4)3= 2Al3++3SO42- Ba2++2OH-+CO2=BaCO3↓+H2O CO2 + OH-=HCO3- Ba2++2OH-+2HCO3- =2H2O + BaCO3↓+CO32- 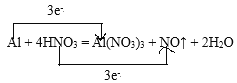 0.6NA或3.612×1023
0.6NA或3.612×1023
【解析】
I.由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则水中硝酸银与氯化钡发生复分解反应;液氨中硝酸钡与氯化银发生复分解反应。上述四种物质在水中形成复分解反应的离子有Ag+和Cl-,则离子方程式为Ag++Cl-=AgCl↓,液氨中硝酸钡与氯化银发生复分解反应,反应的离子方程式为:Ba(NO3)+2AgCl=2AgNO3+BaCl2↓;
II.水中因为氯化银的溶解度最小,所以氯离子与银离子生成氯化银,在液氨中因为氯化钡溶解度最小所以应生成更难溶的氯化钡。离子反应的条件之一由难溶的转变为更难溶的。
(1)H++OH-═H2O表示强酸与强碱反应生成可溶性盐与水的离子反应;
(2)Al2(SO4)3为强电解质,水溶液中完全电离;
(3)少量二氧化碳生成碳酸钡和水,过量二氧化碳生成碳酸氢钡;
(4)⑥与过量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水;
(5)Al元素的化合价由0升高为+3价,以此计算转移电子数。
I.由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则水中硝酸银与氯化钡发生复分解反应;液氨中硝酸钡与氯化银发生复分解反应。上述四种物质在水中形成复分解反应的离子有Ag+和Cl-,则离子方程式为Ag++Cl-=AgCl↓,液氨中硝酸钡与氯化银发生复分解反应,反应的离子方程式为:Ba(NO3)+2AgCl=2AgNO3+BaCl2↓,
故答案为Ag++Cl-=AgCl↓;Ba(NO3)2+2AgCl= BaCl2↓+2AgNO3;
II. (1)上述十种物质中有两种物质之间可发生离子反应:H++OH=H2O,说明是强酸强碱反应生成溶于水的盐的离子反应,氢氧化钡和稀硝酸反应符合,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(2)Al2(SO4)3属于盐是强电解质,水溶液中完全电离,电离方程式为:Al2(SO4)3= 2Al3++3SO42-,
故答案为Al2(SO4)3= 2Al3++3SO42-;
(3)少量的④通入⑥的溶液中反应,是二氧化碳通入氢氧化钡溶液中反应生成碳酸钡沉淀和水,反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O过量的④通入⑥的溶液中反应的离子方程式为CO2 + OH-=HCO3-,
故答案为Ba2++2OH-+CO2=BaCO3↓+H2O;CO2 + OH-=HCO3-;
(4)⑥与过量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水,离子反应为Ba2++2OH-+2HCO3- =2H2O + BaCO3↓+CO32-,
故答案为Ba2++2OH-+2HCO3- =2H2O + BaCO3↓+CO32- ;
(5)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,双线桥法表示为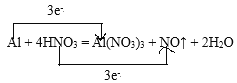 ,当有5.4gAl物质的量=
,当有5.4gAl物质的量=![]() =0.2mol,电子转移为0.2mol×(30)=0.6mol,电子数为0.6NA或3.612×1023,
=0.2mol,电子转移为0.2mol×(30)=0.6mol,电子数为0.6NA或3.612×1023,
故答案为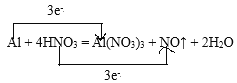 ;0.6NA或3.612×1023。
;0.6NA或3.612×1023。

【题目】已知:AlO+HCO+H2O=Al(OH)3↓+CO![]() ,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2—)>c(OH) |
B | 0.01 | c(CO32—)+c(HCO3—)+c(H2CO3)=c(AlO2—) |
C | 0.015 | c(Na+)>c(CO32—)>c(OH)>c(HCO3—) |
D | 0.03 | c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+c(OH) |
A.AB.BC.CD.D