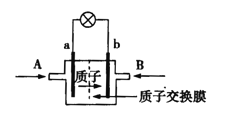
��Ŀ����
����Ŀ����A��B��C��D��E��F����Ԫ�أ�ԭ��������������A��B��C��D��E��Ϊ������Ԫ�أ�D��FΪ��������Ԫ�ء�AԪ��ԭ�Ӻ���ֻ��һ�����ӣ�Ԫ��A��B�γɵ���̬��������ڱ�״���µ��ܶ�Ϊ0.759 g��L-1��CԪ��ԭ�ӵ�����������������Ӳ�����3����E��Cͬ���塣����DԪ�ص���(����������)�������������ת��ȫΪ��������ԭ��Ӧ������FԪ�ص���(����)�������������ת��ȫΪ������ԭ��Ӧ����ش��������⣺
(1)����B�Ľṹʽ��_____ ____��
(2)A��C��1��1�γɵĻ�����ĵ���ʽ_ ____��
(3)FԪ�����ڱ��е�λ�ã�_____ _____��
(4)��A��CԪ����ɵ��⻯�����A��EԪ����ɵ��⻯���������ȶ��Ը�����_________(����������������)��������___ ____��
(5)B��C��E�õ��Ӻ����γɵļ����Ӱ뾶��С�����˳����____ _������������ӷ��ţ�
(6)������FԪ�ص����붡����Һ�з�����Ӧ�����ӷ���ʽ____ _��������DԪ�ص����붡����Һ�з�����Ӧ�����ӷ���ʽ____ _
���𰸡�(1)N��N(2)![]()
(3)��4���ڵ�����
(4)�ߣ���ǽ���OԪ��ǿ��SԪ��
(5)O2-��N3-��S2-(6)Fe+2Fe3+=3Fe2+Al3++3AlO2-+6H2O=4Al(OH)3��
�����������������Ԫ��A��B��C��D��E��F��ԭ��������������A��B��C��D��E��Ϊ������Ԫ�أ�AԪ��ԭ�Ӻ���ֻ��һ�����ӣ���AΪHԪ�أ�Ԫ��A��B�γɵ���̬��������ڱ�״���µ��ܶ�Ϊ0.759gL-1������Ħ������=22.4L/mol��0.759gL-1=17g/mol���������ΪNH3����BΪNԪ�أ�CԪ��ԭ�ӵ�����������������Ӳ�����3������Cԭ�Ӻ�����2�����Ӳ㣬����������Ϊ6����CΪO��Ԫ�أ�E��Cͬ���壬��EΪSԪ�أ� D��FΪ��������Ԫ�أ�����DԪ�ص��ң����������ӣ��������������ת��ȫΪ��������ԭ��Ӧ����DΪAlԪ�أ���ΪAlO2-����ΪAl��OH��3����ΪAl3+������FԪ�ص��ҡ������������ת��ȫΪ������ԭ��Ӧ��FΪ�Ƕ�����Ԫ�أ���FΪFeԪ�أ���ΪFe���ʡ���ΪFe2+����ΪFe3+��
��1��BΪNԪ�أ�����B�ĽṹʽΪN��N��
��2��A��C��1��1�γɵĻ������ǹ������⣬���ڹ��ۻ��������ʽΪ![]() ��
��
��3��FΪFeԪ�أ�FԪ�����ڱ��е�λ���ǵ������ڵ������壻
��4����ǽ���OԪ��ǿ��SԪ�أ�����ˮ���ȶ���ǿ��H2S��
��5��������Ӳ���Խ�࣬���Ӱ뾶Խ���ں�������Ų���ͬʱ�����Ӱ뾶��ԭ���������������С�������Ӱ뾶��С˳��ΪO2-��N3-��S2- ��
��6��FΪFeԪ�أ���ΪFe���ʡ���ΪFe2+����ΪFe3+�����붡����Һ�з�����Ӧ�����ӷ���ʽΪ��Fe+2Fe3+=3Fe2+��DΪAlԪ�أ���ΪAlO2-����ΪAl3+��������DԪ�ص����붡����Һ�з�����Ӧ�����ӷ���ʽΪAl3++3AlO2-+6H2O=4Al(OH)3����
�������ҡ����⿼��Ԫ�ؼ�������ƶϡ����û�ѧ���Ԫ�ػ���������ʵ�
����ʦ���硿��ѧ�ƶ�����һ���ۺ��Խ�ǿ�����⣬��Ԫ�ؼ����������ʺ�������������������ѧ�����֪ʶ����������ѧ�Ƽ��ۺϡ��������ɿ���ѧ���Ի�ѧ֪ʶ������̶ȣ�����Ҫ��������ѧ�����ۺϷ���������˼ά���������ͼ��ķ�������ؼ�����Ѱ����ͻ�ƿ�������ͻ�ƿ�������ץ�������֣�����������ɫ������״̬��������ζ�����ⷴӦ���������������Ʒ���������;�ȡ�