题目内容
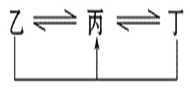
【题目】已知A、B、C均为气体,在体积为10L的恒容密闭容器中进行发生可逆反应,在0~3分钟内各物质的量的变化情况如图所示.请回答下列问题:

①反应开始至2分钟时,B的平均反应速率为 .
②该反应的化学反应方程式为
③由图求3min时A的转化率为 .
【答案】①0.05mol/(L.min);
②2A+B2C;
③40%.
【解析】
试题分析:①化学反应速率是单位时间内浓度的变化,据此可求得反应速率;
②从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程;
③根据A达到平衡时已转化的物质的量与起始的物质的量之比,可求得转化率.
解:①由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率=![]() =0.05mol/(L.min),
=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
②由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C,
故答案为:2A+B2C;
③由图可知:达平衡时,△n(A)=2mol,所以A的转化率为![]() ×100%=40%,
×100%=40%,
故答案为:40%.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无臭气体放出。符合这一情况的是( )
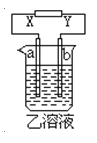
a极板 | b极板 | X电极 | 乙溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素符号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.一定条件下,W单质可以将Z单质从其氢化物中置换出来
D.Y的最高价氧化物对应的水化物能溶于稀氨水