题目内容
(1)多电子原子核外电子能量是不同的,其中能层序数(n)越小,该能层能量______,在同一能层中,各能级的能量按ns、np、nd、nf的次序______.
(2)原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做______原子,当这些原子______能量后电子跃迁到较高能级后就变成激发态.
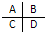
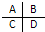
(3)如图是周期表中短周期主族元素的一部分,其中电负性最大的元素是______.第一电离能最小的元素是______.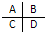
(2)原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做______原子,当这些原子______能量后电子跃迁到较高能级后就变成激发态.
(3)如图是周期表中短周期主族元素的一部分,其中电负性最大的元素是______.第一电离能最小的元素是______.

(1)能层序数(n)越小,电子离核越近,能量越低,在同一能层中,各能级的能量按ns、np、nd、nf的次序递增,故答案为:越低;递增;
(2)处于最低能量的原子叫做基态原子,激发态能量较高,基态电子跃迁到激发态,需要吸收能量,故答案为:基态;吸收;
(3)同周期:从左到右,元素的电负性逐渐增大.同主族:从上到下,元素的电负性逐渐减小则B的电负性最大,第一电离能的变化与元素原子的核外电子排布有关,通常情况下,当原子核外的电子排布的能量相等的轨道上形成全空,半满,全满的结构时,原子的能量较低,原子较稳定,则该原子比较难失去电子,故第一电离能较大,N的第一电离能大于O,由于元素的种类没有确定,则第一电离能最小的元素可能为C或D,
故答案为:B;C或D.
(2)处于最低能量的原子叫做基态原子,激发态能量较高,基态电子跃迁到激发态,需要吸收能量,故答案为:基态;吸收;
(3)同周期:从左到右,元素的电负性逐渐增大.同主族:从上到下,元素的电负性逐渐减小则B的电负性最大,第一电离能的变化与元素原子的核外电子排布有关,通常情况下,当原子核外的电子排布的能量相等的轨道上形成全空,半满,全满的结构时,原子的能量较低,原子较稳定,则该原子比较难失去电子,故第一电离能较大,N的第一电离能大于O,由于元素的种类没有确定,则第一电离能最小的元素可能为C或D,
故答案为:B;C或D.

练习册系列答案
相关题目
 (1)多电子原子核外电子能量是不同的,其中能层序数(n)越小,该能层能量
(1)多电子原子核外电子能量是不同的,其中能层序数(n)越小,该能层能量 (2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(2009?安徽模拟)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题: