��Ŀ����
����Ŀ�����״�����
��.ʹ����ȷ�Ļ�ѧ�������
��1��д���������ʵĵ���ʽ
����_______ �������� _________ ���Ȼ�̼________
��2��д���������ʵĽṹʽ
������̼ ________�������� _________ ������________
��ѧ���⣩��ȷ��д������ĵ���ʽ��Ҫע���������_____________
����ȷ�Ƚ����и����Ӧ��ϵ
��1����֪������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����������Ԫ�أ�
��ԭ�������ɴ�С��˳��Ϊ��___________
��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��___________
�����Ӱ뾶�ɴ�С��˳��Ϊ��___________
��2���Ƚ��������뾶��С���á������������
��F��________Cl�� ��Fe2��________Fe3�� ��O2��_________Mg2��
��ѧ���⣩���Ӱ뾶��С�ȽϷ��������㼴�ɣ�___________
���𰸡� ![]()
![]()
 O=C=O H-O-O-H H-O-Cl ���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ� A>B>D>C B>A>C>D C3��>D��> B��> A2�� �� �� �� ���Ӳ���Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��
O=C=O H-O-O-H H-O-Cl ���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ� A>B>D>C B>A>C>D C3��>D��> B��> A2�� �� �� �� ���Ӳ���Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��
�������������������.��1�����������д��ڵ�����������ԭ�������Ϊ8���ӣ���������Ϊ���ӻ��������ʽ����Ҫ�����������������ɣ����Ȼ�̼Ϊ���ۻ����̼ԭ�ӡ���ԭ������㶼��8�����ӣ���2��������̼�д�������̼��˫����˫��ˮΪ���ۻ���������д��������������һ��O-O��������������д���H-O����O-Cl������1��������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����A��B��C��D�����ڱ��е�λ���� ����2�����Ӳ���Խ��뾶Խ���Ӳ���������������ͬ��������Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС��
����2�����Ӳ���Խ��뾶Խ���Ӳ���������������ͬ��������Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС��
��������.��1�����������д��ڵ�����������ԭ�������Ϊ8���ӣ�N2�ĵ���ʽΪ����![]() ����������Ϊ���ӻ��������ʽ����Ҫ�����������������ɣ��������Ƶĵ���ʽΪ
����������Ϊ���ӻ��������ʽ����Ҫ�����������������ɣ��������Ƶĵ���ʽΪ![]() �����Ȼ�̼Ϊ���ۻ����̼ԭ�ӡ���ԭ������㶼��8�����������Ȼ�̼�ĵ���ʽΪ
�����Ȼ�̼Ϊ���ۻ����̼ԭ�ӡ���ԭ������㶼��8�����������Ȼ�̼�ĵ���ʽΪ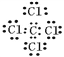 ����2��������̼�д�������̼��˫�����ṹʽΪO=C=O��˫��ˮΪ���ۻ���������д��������������һ��O-O�����ṹʽΪH-O-O-H������������д���H-O����O-Cl����������Ľṹʽ��H-O-Cl����ȷ��д������ĵ���ʽ��Ҫע���������:���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ���1��������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����A��B��C��D�����ڱ��е�λ����
����2��������̼�д�������̼��˫�����ṹʽΪO=C=O��˫��ˮΪ���ۻ���������д��������������һ��O-O�����ṹʽΪH-O-O-H������������д���H-O����O-Cl����������Ľṹʽ��H-O-Cl����ȷ��д������ĵ���ʽ��Ҫע���������:���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ���1��������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����A��B��C��D�����ڱ��е�λ���� ��������ԭ�������ɴ�С��˳��Ϊ��A>B>D>C����B��A���Ӳ�������C��D�����뾶B��A����C��D��ͬ����Ԫ�ش����Ұ뾶��С��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��B>A>C>D���۵��Ӳ�����ͬ��������Խ��뾶ԽС�����Ӱ뾶�ɴ�С��˳��Ϊ��C3��>D��> B��> A2������2���ٵ��Ӳ���Խ��뾶Խ��������F��<Cl���������Ӳ���������������ͬ��������Խ��뾶Խ������Fe2��>Fe3�����۵��Ӳ�����ͬ��������Խ��뾶ԽС������O2��>Mg2�������Ӱ뾶��С�ȽϷ��������Ӳ���Խ��뾶Խ�������Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��
��������ԭ�������ɴ�С��˳��Ϊ��A>B>D>C����B��A���Ӳ�������C��D�����뾶B��A����C��D��ͬ����Ԫ�ش����Ұ뾶��С��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��B>A>C>D���۵��Ӳ�����ͬ��������Խ��뾶ԽС�����Ӱ뾶�ɴ�С��˳��Ϊ��C3��>D��> B��> A2������2���ٵ��Ӳ���Խ��뾶Խ��������F��<Cl���������Ӳ���������������ͬ��������Խ��뾶Խ������Fe2��>Fe3�����۵��Ӳ�����ͬ��������Խ��뾶ԽС������O2��>Mg2�������Ӱ뾶��С�ȽϷ��������Ӳ���Խ��뾶Խ�������Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�