题目内容
20.NA代表阿伏加德罗常数,以下说法正确的是( )| A. | 12lg CCl2F2所含的氯原子数为2NA | |
| B. | 常温常压下l mol NO2气体与水反应生成NA个NO3一离子 | |
| C. | 氯化氢气体的摩尔质量等于NA个氯原子和NA个氢原子的质量之和 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
分析 A、求出CCl2F2的物质的量,然后根据1molCCl2F2中含2mol氯原子来分析;
B、3mol二氧化氮与水反应生成2mol硝酸和1mol一氧化氮;
C、摩尔质量与质量的单位不同;
D、Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子;
解答 解:A、121gCCl2F2的物质的量n=$\frac{121g}{121g/mol}$=1mol,而1molCCl2F2中含2mol氯原子即2NA个,故A正确;
B、1mol二氧化氮与水反应生成$\frac{1}{3}$mol一氧化氮和$\frac{2}{3}$mol硝酸,生成的硝酸根离子的物质的量为$\frac{2}{3}$mol,故B错误;
C、摩尔质量单质为g/mol,质量单位为g,二者是单位不同的物理量,故只能说氯化氢气体的摩尔质量与NA个氯原子和NA个氢原子的质量之和在数值上相等,故C错误;
D、Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
10.某小分子抗癌药物的分子结构如图所示,下列说法正确的是( )


| A. | 1mol该有机物最多可以和5mol NaOH反应 | |
| B. | 1mol该有机物与浓溴水反应,最多消耗3mol Br2 | |
| C. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| D. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
11.下列物质能跟镁反应并生成氢气的是( )
| A. | 常温下在蒸馏水中 | B. | 氢氧化钠溶液 | ||
| C. | 氯化铵溶液 | D. | 碳酸钠溶液 |
8.不溶于水,且密度小于水的是( )
| A. | 苯 | B. | 乙酸 | C. | 四氯化碳 | D. | 酒精 |
15.下列过程的离子方程式正确的是( )
| A. | 氨水与醋酸的反应:NH3•H2O+CH3COOH=CH3COO-+NH4 ++H2O | |
| B. | 大理石与盐酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+OH-+Ba2+=BaSO4↓+H2O | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
12.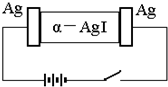 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关结论正确的是( )| A. | 若α-AgI是Ag+导电则通电一段时间后晶体密度不均匀 | |
| B. | 若α-AgI是Ag+导电则通电一段时间后晶体密度可能均匀 | |
| C. | 若α-AgI是I-导电则通电一段时间后晶体密度不均匀 | |
| D. | 若α-AgI是I-导电则通电一段时间后晶体密度仍均匀 |
 .
. (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下: