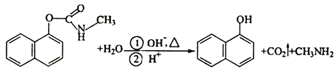
题目内容
【题目】草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
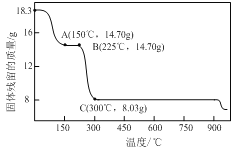
①通过计算确定C点剩余固体的化学成分为________(填化学式);试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_______________________________________________;
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比________________。
【答案】 Co3O4 3CoC2O4+2O2=Co3O4+6CO2 5:6
【解析】(1)由图可知,CoC2O42H2O的质量为18.3g,其我知道可为0.1mol,Co元素质量为5.9g,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol: ![]() ≈3:4,故C的Co氧化物为Co3O4;B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2
≈3:4,故C的Co氧化物为Co3O4;B点对应物质的质量为14.7g,与其起始物质的质量相比减少18.3g-14.7g=3.6g,为结晶水的质量,故B点物质为CoC2O4,与氧气反应生成Co3O4与二氧化碳,反应方程式为:3CoC2O4+2O2![]() Co3O4+6CO2,故答案为:Co3O4;3CoC2O4+2O2
Co3O4+6CO2,故答案为:Co3O4;3CoC2O4+2O2![]() Co3O4+6CO2;
Co3O4+6CO2;
(2)由电子守恒:n(Co3+)=2 n(Cl2)=2×![]() =0.4 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=
=0.4 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=![]() n(Cl-)=
n(Cl-)=![]() ×( 0.48L×5mol/L-2×
×( 0.48L×5mol/L-2×![]() )=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,根据化合价电荷守恒为0,氧化物中n(O)=(0.6mol×2+0.4mol×3)÷2=1.2mol,故该钴氧化物中n(Co):n(O)=1mol:1.2mol=5:6,故答案为:5:6。
)=1 mol,所以固体中的n(Co2+)=1mol-0.4mol=0.6 mol,根据化合价电荷守恒为0,氧化物中n(O)=(0.6mol×2+0.4mol×3)÷2=1.2mol,故该钴氧化物中n(Co):n(O)=1mol:1.2mol=5:6,故答案为:5:6。

 53随堂测系列答案
53随堂测系列答案【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |

A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a