题目内容
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+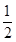 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+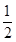 O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= kJ·mol-1。
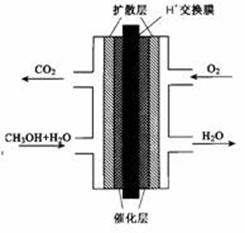
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),正极发生的电极反应式为 。负极发生的电极反应式为 。

(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+
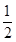 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2已知H2(g)+
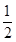 O2(g)=H2O(g) △H ="-241.8" kJ·mol-1
O2(g)=H2O(g) △H ="-241.8" kJ·mol-1则反应②的△H2= kJ·mol-1。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),正极发生的电极反应式为 。负极发生的电极反应式为 。
(1)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.51kJ/mol (2)-192.8
(3)负 O2+4H++4e-=2H2O CH3OH+H2O-6e-=CO2↑+6H+
(3)负 O2+4H++4e-=2H2O CH3OH+H2O-6e-=CO2↑+6H+
试题分析:(1)1molCH3OH完全燃烧生成稳定的氧化物为气态二氧化碳和液态水,放出热量726.51kJ/mol,则燃烧的热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.51kJ/mol。
(2)由盖斯定律可知,①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0kJ/mol、③H2(g)+
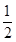 O2(g)=H2O(g) △H=-241.8 kJ/mol。则①+③得到反应②,即则△H2=+49.0kJ/mol+(-241.8kJ/mol)=-192.8kJ/mol。
O2(g)=H2O(g) △H=-241.8 kJ/mol。则①+③得到反应②,即则△H2=+49.0kJ/mol+(-241.8kJ/mol)=-192.8kJ/mol。(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2↑+6H+;氧气在正极通入,得到电子,电极反应式是O2+4H++4e-=2H2O。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,注重高考常考考点的考查,旨在培养学生分析、归纳和总结问题的能力。有利于调动学生的学习兴趣,激发学生的学习积极性。

练习册系列答案
相关题目

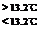 Sn(s、白) + Q3, Q3=" -" 2.1kJ
Sn(s、白) + Q3, Q3=" -" 2.1kJ H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )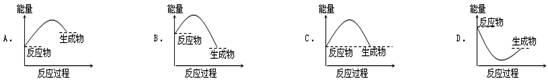
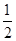 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 Fe(s)+CO2(g)
Fe(s)+CO2(g)