题目内容
20.依据第2周期元素第一电离能的变化规律,参照图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
分析 同周期自左而右元素的第一电离能呈增大趋势,但氮元素的2p能级容纳3个电子,处于半满稳定状态,能力降低,氮元素的第一电离能高于同周期相邻元素.据此分析.
解答 解:同周期自左而右元素的第一电离能呈增大趋势,但氮元素的2p能级容纳3个电子,处于半满稳定状态,能力降低,氮元素的第一电离能高于同周期相邻元素,故C、N、O三种元素的相对位置为: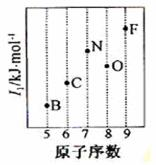 ,故答案为:
,故答案为: ;
;
点评 本题考查元素在周期表中的位置和核外电子排布对第一电离能的影响,难度中等,注意把握元素在周期表中的位置和电子排布式的书写方法.

练习册系列答案
相关题目
10.下列叙述中错误的是( )
| A. | 将等物质的量的甲烷与氯气充分反应生成物中物质的量最大的是CH3Cl | |
| B. | 苯乙烯生成乙基环己烷不属于取代反应 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 煤的干馏、石油裂化和乙烯聚合均属于化学变化 |
15.下列说法正确的是( )
| A. | 按系统命名法,化合物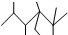 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| C. | 苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段 的高聚物是由加聚反应形成,其单体分子式为C7H60 的高聚物是由加聚反应形成,其单体分子式为C7H60 |
5.长周期中的某主族元素R,其原子核外最外电子层上只有1个电子,下列叙述中正确的是( )
| A. | R的单质常温下跟水反应不如钠剧烈 | |
| B. | R的碳酸盐易溶于水 | |
| C. | R的原子半径比钾的原子半径小 | |
| D. | R的氢氧化物不能使氢氧化铝溶解 |
12.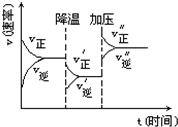 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 若A、B是气体,则D是液体或固体 | B. | A、B、C、D均为气体 | ||
| C. | 逆反应是放热反应 | D. | 达平衡后,v(A)正=2 v(C)逆 |
10.下列说法错误的是( )
| A. | FeO是碱性氧化物 | |
| B. | 用加热法分离泥沙中的碘单质是化学变化 | |
| C. | 丁达尔效应可用于区分胶体和溶液 | |
| D. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 是复分解反应 |
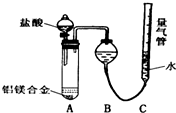 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究.填写下列空白. 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: