题目内容
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下:

请回答:
(1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。
(2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。
(3)MgO的熔点高于CuO的原因为______________________________________。
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键________________。
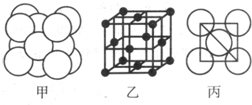
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(9分)
(1)12 1∶1
(2)正四面体形 sp3
(3)MgO的晶格能大(其他合理答案也可)
(4)
(5)1:3 (197+64×3)×1030/a3NA
【解析】
试题分析:(1)SiO2不与稀硫酸反应,故沉淀A是SiO2,SiO2是原子晶体,晶体中最小环上的原子个数为12。气体C是CO2,分子中σ键和π键的个数比为1:1。
(2)溶液D是CuSO4溶液,阴离子是SO42-,空间构型为正四面体形,中心原子的杂化轨道类型为sp3。
(3)MgO的熔点高于CuO的原因为MgO的晶格能比CuO的大。
(4)Cu2+周围有四个配位键,其图示为 。
。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为1:3,若该晶胞的边长为a pm,则合金的密度为(197+64×3)×1030/a3NA g·cm-3。
考点:金属及其重要化合物的主要性质 共价键 晶体
点评:金属及其重要化合物的主要性质、共价键、晶体等都是和实验有密切联系,认真复习课本中的实验,弄清实验原理、目的、要求、步骤和注意事项等实验基础知识,并能做到举一反三,是我们做好实验复习的保证。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2012?成都模拟)一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
(2012?成都模拟)一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4?H2O]是一种重要的染料及农药中间体.请回答下列相关问题: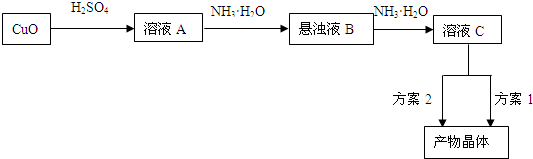
 Cu2++4NH3
Cu2++4NH3

 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
 键和
键和 键的个数比为______
键的个数比为______ 的配位键____________。
的配位键____________。