题目内容
【题目】【2017届湖北省孝感市高三上第一次统考】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
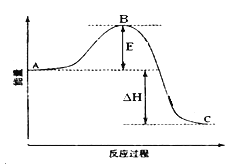
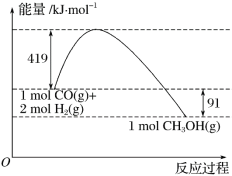
已知①常压下反应的能量变化如图所示。
②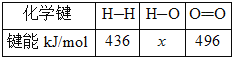
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
【答案】
(1)CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
(2)462;(3)510;
【解析】(1)燃烧热的热化学方程式中,可燃物为1mol,反应生成稳定的氧化物。由图1可得热化学方程式:①CO(g)+2H2(l)=CH3OH(g)△H=-91kJ/mol,又已知:②CO(g)+![]() O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+
O2(g)═CO2(g)△H=-280kJ/mol,③H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,根据盖斯定律,③×2+②-①可得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1,故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1,故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
O2(g)=CO2(g)+2H2O(l)△H=-757kJmol-1;
(2)已知:H2(g)+![]() O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+
O2(g)═H2O(l)△H=-284 kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol,二者相加可得:H2(g)+![]() O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+
O2(g)═H2O(g)△H=-240 kJ/mol,反应热=反应物总键能-生成物总键能,则436kJ/mol+![]() ×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,故答案为:462;
×496kJ/mol-2×x kJ/mol=-240kJ/mol,解得x=462,故答案为:462;
(3)根据图像,甲醇气体分解为CO和H2两种气体的反应的活化能=91 kJ/mol +419 kJ/mol =510 kJ/mol,故答案为:510;

【题目】下表为元素周期表的一部分,请用化学用语回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和⑧的元素符号是______和______;
(2)元素⑥形成的氢化物的电子式是______;
(3)表中能形成两性氢氧化物的元素是______(填写元素符号),请写出该元素的氢氧化物与⑨最高价氧化物对应的水化物发生反应的化学方程式_______________________。