题目内容
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
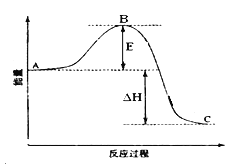
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”)。
(2)图中△H= kJ·mol-1;
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
【答案】(1)反应物总能量;生成物总能量;无;降低;不变(2)—198
(3)CO(g)+FeO(s)=Fe(s)+C02(g)△H=-218.00kJ/mol
【解析】
试题分析:(1)根据图像可知图中A、C分别表示反应物总能量,生成物总能量;根据图像,E为(正反应)活化能;反应热=生成物的总能量-反应物的总能量,E的大小对该反应的反应热无影响;催化剂能改变反应路径,使反应所需的活化能降低;但不能改变反应热;
(2)反应热=生成物的总能量-反应物的总能量,则ΔH=—198kJ·mol-1;
(3)已知;①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
②3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
则根据盖斯定律可知(①×3-③×2+②)÷6即得到CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式为CO(g)+FeO(s)=Fe(s) + C02(g) △H=-218.00 kJ/mol。

 高中必刷题系列答案
高中必刷题系列答案