题目内容
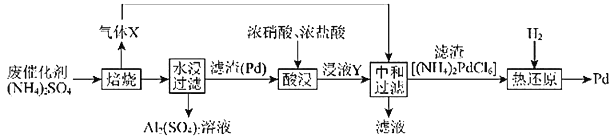
【题目】工业上利用氧化铝基废催化剂(主要成分为![]() ,还含有少量Pd)回收
,还含有少量Pd)回收![]() 及Pd的流程如图:
及Pd的流程如图:
(1)![]() 溶液蒸干灼烧后所得物质的化学名称是_________。
溶液蒸干灼烧后所得物质的化学名称是_________。
(2)焙烧时![]() 与
与![]() 反应的化学方程式为__________。
反应的化学方程式为__________。
(3)浸液Y中含Pd元素的溶质是______(填化学式)。
(4)“热还原”中每生成![]() 生成的气体的物质的量为_________(已知热还原得到的固体只有Pd)。
生成的气体的物质的量为_________(已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为![]() ,其中x的最大值为0.8。已知:Pd的密度为
,其中x的最大值为0.8。已知:Pd的密度为![]() ,则
,则![]() 能储存标准状况下
能储存标准状况下![]() 的最大体积为________L(保留三位有效数字)。
的最大体积为________L(保留三位有效数字)。
【答案】硫酸铝 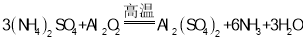
![]()
![]() 10.8
10.8
【解析】
废催化剂(主要成分为Al2O3,含少量Pd ), 废催化剂硫酸铵焙烧得到气体X为氨气,产物水浸过滤得到硫酸铝溶液,滤渣Pd加入浓硝酸和浓盐酸酸浸生成二氧化氮,浸液Y是Pd溶于王水发生Pd + 6HCl + 4HNO3![]() H2PdCl6+ 4NO2↑+4H2O,Y为
H2PdCl6+ 4NO2↑+4H2O,Y为![]() 。 通入氨气中和过滤得到滤渣(NH4)2 PdCl6, 被氢气还原得到发生( NH4)2PdCl6+2H2=Pd+2NH3+6HCl反应。
。 通入氨气中和过滤得到滤渣(NH4)2 PdCl6, 被氢气还原得到发生( NH4)2PdCl6+2H2=Pd+2NH3+6HCl反应。
(1)由于硫酸难挥发,则硫酸铝不会发生改变,蒸干灼烧后仍然为硫酸铝,故答案为:硫酸铝;
(2)从流程中得知,反应物为(NH4)2SO4和Al2O3,生成物包括NH3和Al2(SO4)3,化学方程式为: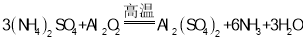 ,故答案为:
,故答案为: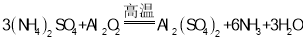 ;
;
(3)浸液Y的主要成分为是Pd,溶于王水生成的络合物:Pd + 6HCl + 4HNO3![]() H2PdCl6+ 4NO2↑+4H2O,Y为
H2PdCl6+ 4NO2↑+4H2O,Y为![]() ,故答案为:
,故答案为:![]() ;
;
(4)热还原得Pd,根据( NH4)2PdCl6+2H2=Pd+2NH3+6HCl反应,可知要生成物中气体有氨气和氯化氢,生成1molPd,则还有2mol氨气和6molHCl,故气体物质的量为8mo,故答案为:8mol ;
(5)已知: Pd的密度为![]() ,10.6cm3Pd的质量为
,10.6cm3Pd的质量为![]()
![]() 10.6cm3 = 127.2g,物质的量为n=
10.6cm3 = 127.2g,物质的量为n=![]() =1.2mol,根据 2Pd(s) + xH2(g)= 2PdHx(s)方程式可知消耗H2的物质的量为0.48mol,则1cm3Pd能够储存标准状况下H2的最大体= 0.48mol
=1.2mol,根据 2Pd(s) + xH2(g)= 2PdHx(s)方程式可知消耗H2的物质的量为0.48mol,则1cm3Pd能够储存标准状况下H2的最大体= 0.48mol ![]() 22.4L/ mol≈10.8L ,故答案为:10.8L。
22.4L/ mol≈10.8L ,故答案为:10.8L。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】在三个容积均为2L的密闭容器中按不同方式投入反应物,发生反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0),相关反应数据如下:
容器 | 容器类型 | 起始温度/℃ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
CO | H2O | CO2 | H2 | ||||
Ⅰ | 恒温容器 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
Ⅱ | 恒温容器 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
Ⅲ | 绝热容器 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是
A.容器Ⅰ中反应经10min建立平衡,0~10min内,平均反应速率v(CO)=0.04 mol·L-1·min-1
B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将逆向移动
C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ
D.达平衡时,容器Ⅲ中n(CO)<0.48 mol