题目内容
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B.常温常压下,16gO2所含的电子数为8NA
C.标准状况下,22.4LSO3中所含的SO3分子数为NA
D.78gNa2O2与足量水充分反应时电子转移数为2NA
【答案】B
【解析】
A. 二氧化锰只能与浓盐酸反应,和稀盐酸不反应,随着反应的进行,盐酸变稀,故4mol盐酸不能反应完全,则生成的氯气分子小于1mol,故A错误;
B.16g氧气的物质的量为:![]() ,0.5mol氧气分子中含有的电子为:16×0.5mol=8mol,则含有8NA个电子,故B正确;
,0.5mol氧气分子中含有的电子为:16×0.5mol=8mol,则含有8NA个电子,故B正确;
C. 标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D.78g过氧化钠的物质的量为1mol,而过氧化钠与水的反应是歧化反应,1mol过氧化钠转移1mol电子,即NA个,故D错误;
故选B。

练习册系列答案
相关题目
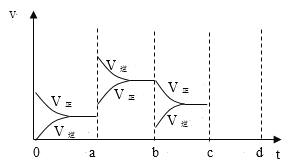
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为K=________。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是________,该反应的△H________0。(填“![]() ”、“
”、“![]() ”或“=”)
”或“=”)
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的关系为_______(用“![]() ”、“
”、“![]() ”或“=”连接)。
”或“=”连接)。