题目内容
【题目】按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )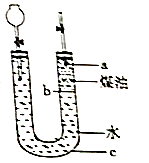
A.打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
【答案】C
【解析】A.钠的密度大于煤油,所以会沉在煤油中,A不符合题意;
B.钠的密度大于煤油而小于水,钠和水剧烈反应生成氢气,钠和煤油不反应,所以钠会沉在煤油中而漂浮在水面上,钠和水剧烈反应生成的氢气将钠带离水而进入煤油中,又因为重力作用而进入水中,如此往返,B不符合题意;
C.钠和水反应生成NaOH和氢气,生成的氢气导致左端液面上升,进入长颈漏斗,a处有无色气体产生,C符合题意;
D.乙醇和水互溶,所以不会出现相同的实验现象,D不符合题意;
故答案为:C
A.钠的密度比煤油大,会下沉;
B.钠的密度大于煤油而小于水,故钠会在分界面发生反应,且上下跳动;
C.钠与水反应生成氢气,使得右边压强变大;
D.酒精与水互溶,不分层;

【题目】已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7 Ka2=4.7×10﹣11 |
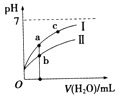
A.如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O═2HClO+CO32﹣
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
【题目】下列实验与对应示意图的关系正确的是( )
A | B | C | D |
NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
|
|
|
|
A.A
B.B
C.C
D.D