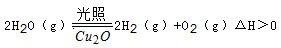题目内容
下列叙述正确的是
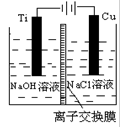
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
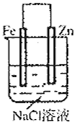
| B.在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
D
试题分析:A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止气体分子通过,错误;B.在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的,错误;C.用惰性电极电解Na2SO4溶液,实质是电解水,在阴极上产生氢气,在阳极上产生氧气,阴阳两极产物的物质的量之比为2:1.错误;D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则有1mol的H+放电,所以会生成1 molNaOH,正确。

练习册系列答案
相关题目


 Cu2O + H2↑。
Cu2O + H2↑。