题目内容
【题目】电镀废水沉泥中含Cu、Ni、Ag和Fe等多种元素的有机金属盐,采用焙烧一浸出—分离回收的工艺流程可有效分离电镀废水沉泥中的金属,其流程如下:
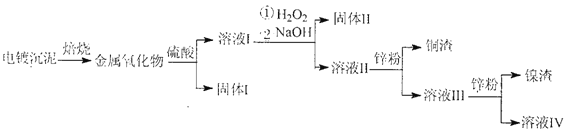
下列叙述错误的是
A. 上述流程中硫酸可以用稀盐酸代替
B. “固体Ⅱ”为Fe(OH)2
C. 溶液III中含有Na+、Ni2+、Zn2+等金属离子
D. 合理处理电镀废沉泥可实现资源的回收与可持续利用
【答案】B
【解析】
电镀废水沉泥中含Cu、Ni、Ag和Fe等多种元素的有机金属盐,采用焙烧后变成CuO、NiO、Fe3O4等,加硫酸溶解,固体I是银单质,溶液I中有Na+、Fe2+、Fe3+、Ni2+、Cu2+,加双氧水将亚铁离子氧化成铁离子,再加NaOH溶液,生成固体Ⅱ:Fe(OH)3,溶液Ⅱ中有Na+、Ni2+、Cu2+,加锌先生成铜,得溶液III中含有Na+、Ni2+、Zn2+等金属离子,再加过量的锌,得镍和溶液Ⅳ为硫酸锌溶液。
A. 上述流程中硫酸可以用稀盐酸代替,主要是溶解CuO、NiO、Fe3O4等金属氧化物,故A正确;
B. “固体Ⅱ”为Fe(OH)3,故B错误;
C.溶液I中有Na+、Fe2+、Fe3+、Ni2+、Cu2+,加双氧水将亚铁离子氧化成铁离子,再加NaOH溶液,生成固体Ⅱ:Fe(OH)3,溶液Ⅱ中Na+、Ni2+、Cu2+,加锌先生成铜,得溶液III中含有Na+、Ni2+、Zn2+等金属离子,故C正确;
D. 从流程看出可以回收利用铜镍等金属,故合理处理电镀废沉泥可实现资源的回收与可持续利用,故D正确;
故选B。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25









