题目内容
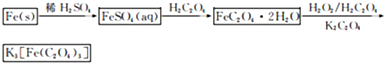
草酸合铁(Ⅲ)酸钾晶体Kx[Fey(C2O4)z]·nH2O可用于摄影和蓝色印刷。为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
实验Ⅰ.草酸根含量的测定
称取0.9820 g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358 K,用0.2000 mol·L-1 KMnO4溶液滴定,滴定过程中草酸根离子转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4溶液12.00 ml。
实验Ⅱ.铁含量的测定
将上述滴定过草酸根的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液做指示剂,用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液8.00 ml。(已知:实验Ⅱ中涉及的部分离子方程式为:I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题
(1)实验Ⅰ在滴定过程中反应的离子方程式为 。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。若实验Ⅱ中没有对实验Ⅰ的保留液进行充分加热,则测定的Fe3+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)实验Ⅱ用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成(写出计算过程)。
(1)2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑ (2分)
(2)偏高(2分)
(3)滴下最后一滴Na2S2O3标准溶液,溶液由蓝色变成无色,且半分钟内不变色(2分)
(4)(6分)
2MnO4- ~ 5C2O42- 2S2O32- ~ I2 ~ 2 Fe3+
2 5 2 2
0.2×12×10-3mol n (C2O42-) 0.25×8×10-3mol n (Fe3+)
n (C2O42-)= 6×10-3mol (1分) n (Fe3+)= 2×10-3mol (1分)
根据电荷守恒原理:n (K+)=6×10-3mol (1分)
根据质量守恒原理m (H2O)=0.9820-39×6×10-3-56×2×10-3-88×6×10-3=0.108g
n (H2O)=6×10-3 mol (1分)
n (K+):n (Fe3+):n (C2O42-):n (H2O)=3:1:3:3 (1分)
化学式为:K3Fe(C2O4)3·3H2O (1分)

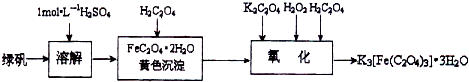
 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下: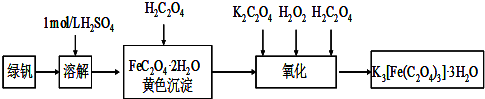

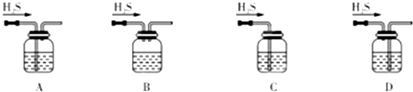
 图所示装置的减压过滤与母液分离.
图所示装置的减压过滤与母液分离.