题目内容
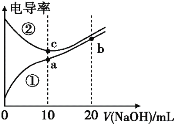
【题目】向0.1 mol/L二元弱酸H2A溶液中逐滴滴加0.1 mol/L NaOH溶液,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述错误的是
]。下列叙述错误的是

A.lg[K1(H2A)]=-1.2
B.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
C.0.05 mol/L的NaHA溶液中一定存在:c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
【解析】
A.根据图知,H2A溶液中存在A2-、HA-、H2A,说明H2A是二元弱酸,当c(HA-)=c(H2A)时,溶液的pH=-1.2,则溶液中c(H+)=10-1.2,K1(H2A)=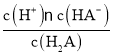 =c(H+)=10-1.2,所以lg[K1(H2A)]=lg10-1.2=-1.2,A正确;
=c(H+)=10-1.2,所以lg[K1(H2A)]=lg10-1.2=-1.2,A正确;
B. pH=2.7时,根据图知c(HA-)>c(H2A)=c(A2-),B正确;
C. NaHA是强碱弱酸盐,NaHA电离产生Na+、HA-, HA-在溶液中既存在电离作用也存在水解作用,所以溶液中Na+浓度最大,但盐电离和水解程度是微弱的主要以HA-存在,则c(Na+)>c(HA-)溶液呈酸性,说明HA-电离程度大于水解程度,所以c(A2-)>c(H2A),故溶液中离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)>c(H2A),C正确;
D. pH=4.2时,HA-、A2-含量相同,则c(HA-)=c(A2-),溶液为Na2A、NaHA等浓度的混合溶液,根据元素守恒可知是H2A与NaOH溶液按2:3体积比混合,所得混合溶液中c(HA-)=c(A2-)=![]() ×
×![]() =0.02 mol/L,此时溶液中c(H+)=10-4.2 mol/L,故离子浓度关系为c(HA-)=c(A2-)>c(H+),D错误;
=0.02 mol/L,此时溶液中c(H+)=10-4.2 mol/L,故离子浓度关系为c(HA-)=c(A2-)>c(H+),D错误;
故合理选项是D。

【题目】为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做如表四组实验:
编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
实验 |
|
|
|
|
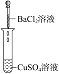
(1)实验Ⅰ的现象________,写出反应的离子方程式________。
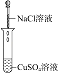
(2)实验Ⅱ的目的是________。
(3)实验Ⅲ的现象证明了溶液中的________两种离子之间发生了化学反应。
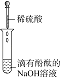
(4)实验Ⅳ中发生反应的离子方程式是________。