题目内容
9.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 标准状况下,22.4L的H2O含NA个水分子 | |
| B. | 1.8g的NH4+离子中含有的电子数为 NA | |
| C. | 5.6 g 铁在足量氯气中燃烧,电子转移0.2 NA个 | |
| D. | 常温常压下,32g臭氧和氧气的混合物含有的氧原子数为 NA |
分析 A、标况下,水为液体;
B、求出铵根离子的物质的量,然后根据1mol铵根离子中含10mol电子来分析;
C、求出铁的物质的量,然后根据铁与氯气反应后变为+3价来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、标况下,水为液体,不能根据气体摩尔体积来计算其物质的量,故A错误;
B、1.8g铵根离子的物质的量为0.1mol,而1mol铵根离子中含10mol电子,故0.1mol铵根离子中含1mol电子即NA个,故B正确;
C、5.6g铁的物质的量为0.1mol,而铁与氯气反应后变为+3价,故0.1mol铁转移0.3mol电子即0.3NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
19.钛(Ti)金属常被称为未来钢铁.钛元素的同位素${\;}_{22}^{46}$Ti、${\;}_{22}^{47}$Ti、${\;}_{22}^{48}$Ti、${\;}_{22}^{49}$Ti、${\;}_{22}^{50}$Ti中,中子数不可能为( )
| A. | 26 | B. | 28 | C. | 22 | D. | 24 |
17.要想除去氯气中含有少量的氯化氢气体最好让气体通过( )
| A. | 氨水 | B. | 浓硫酸 | C. | 饱和氯化钠溶液 | D. | 饱和石灰水 |
4.下列说法正确的是( )
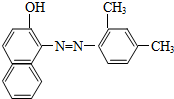

| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到,发生了化学反应 | |
| B. | 干馏煤可以得到苯和氨等重要化工原料 | |
| C. | 如图所示物质属于芳香烃 | |
| D. | 如图所示物质能被酸性高锰酸钾氧化 |
14.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 氢氧化钠与稀硫酸反应 | B. | 灼热的炭与水蒸气反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧 |
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 水电离的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、AlO2-、Cl- | |
| B. | 使石蕊变红色的溶液中:Na+、Al3+、SO42-、CO32- | |
| C. | Kw/C(H+)=1×10-13mol•L-1的溶液中:NH4+、Fe3+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、SO42- |
18.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
Fe3+→Fe2+ MnO4-→Mn2+ Cr2O72-→Cr3+ HNO3→NO
如果分别用上述这些物质氧化KI得到等量的I2,消耗物质的量最少的物质是( )
| A. | Fe3+ | B. | MnO4- | C. | Cr2O72- | D. | HNO3 |