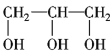题目内容
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的电子排布式为________,Y的电子排布图为___________;
(2)ZX2的分子式是_________,分子构型为________。YX2的电子式是________,分子构型为_________,中心原子发生了_________杂化。
(3)Y与Z形成的化合物的分子式是____。Y的氢化物中分子构型为正四面体的是_________(填名称),键角为____,中心原子的杂化形式为_________。
(4)X的氢化物的分子构型为_________,键角为_________,中心原子的杂化形式_________。
【答案】1s22s22p4 ![]() SO2 V形
SO2 V形 ![]() 直线形 sp CS2 甲烷 109°28' sp3 V形 105° sp3
直线形 sp CS2 甲烷 109°28' sp3 V形 105° sp3
【解析】
化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s2p2,故Y为碳元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素。
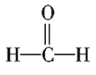
(1)由上述分析可知,X为O元素,其电子排布式为1s22s2p4,Y为C元素,原子核外电子排布为1s22s2p2,故其轨道表示式为![]() ;
;
(2)由上述分析可知,ZX2的分子式是SO2,SO2的分子中价层电子对个数是2+![]() (6-2×2)=3,且含有一个孤电子对,所以其空间构型为V型,YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,杂化方式为sp杂化,分子为直线型,其电子式是
(6-2×2)=3,且含有一个孤电子对,所以其空间构型为V型,YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,杂化方式为sp杂化,分子为直线型,其电子式是![]() ;
;
(3)C与S形成的化合物是CS2,Y的氢化物中分子构型为正四面体的是甲烷,甲烷分子中碳原子含有4个共价单键,且不含孤电子对,所以碳原子为sp3杂化,所以分子为正四面体型,键角为109°28′;
(4)O的最简单氢化物是水,水分子是V形结构,水分子中中键角为105°,水分子中O原子含有2个共价单键,有两对孤电子对,所以O原子为sp3杂化。