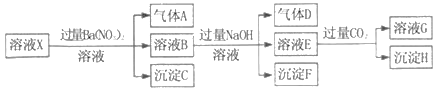
��Ŀ����
����Ŀ��I����0.1 gMnO2��ĩ����50 mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��
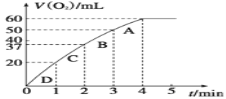
���ͷ�Ӧ���ʱ仯��ԭ��____________________________������H2O2�ij�ʼ���ʵ���Ũ��Ϊ_________��(������λ��Ч����)
���ͼ������������Ĵ������ʣ��ش��������⣺
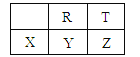
(1) ���³�ѹ�£���ֱ̬��������̼ԭ������_________ ��
(2) ���ͼ����к�̼���ϸߵ���__________��
(3) ���������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ����________________��
(4)д�������嵥�ʷ�Ӧ�Ļ�ѧ����ʽ __________________________________��
���𰸡����ŷ�Ӧ�Ľ��У�˫��ˮ��Ũ�ȼ��٣���Ӧ���ʼ��� 0.11mol/L 4 �� �� ![]()
��������
I.��ͬʱ������������Խ�࣬��Ӧ����Խ�죻��ͼ��֪������������Ϊ60mL����Ϸ�Ӧ��c=![]() ���㡣
���㡣
II.(1)���³�ѹ����ֱ̬��������̼ԭ������4��
(2)���������ʽ�жϺ�̼���ߵͣ�
(3)���顢��ȼ�����ɶ�����̼��ˮ�����ݷ���ʽ�ж���������������С��
(4)���廯�������������£�����Һ�巢��ȡ����Ӧ�����屽��HBr��
I.��ͬʱ������������Խ�࣬��Ӧ����Խ�죬�������20mL��17mL��13mL��10mL����Ӧ����ΪD��C��B��A����Ӧ���ʱ仯��ԭ�����������ŷ�Ӧ�Ľ��У�˫��ˮ��Ũ�ȼ��٣�Ũ��ԽС����Ӧ���ʼ�����
H2O2��ȫ��Ӧ�ų�60 mL O2��H2O2�ķֽⷴӦΪ2H2O2 ![]() 2H2O+O2������n(H2O2)=2
2H2O+O2������n(H2O2)=2![]() ��0.00536 mol����H2O2�ij�ʼ���ʵ���Ũ��Ϊ��c(H2O2)=
��0.00536 mol����H2O2�ij�ʼ���ʵ���Ũ��Ϊ��c(H2O2)=![]()
��0.11 mol/L��
II.(1)���³�ѹ����ֱ̬��������̼ԭ������4��
(2)���������ʽ�жϺ�̼���ߵͣ�����ķ���ʽ�����ʽ����CH4���������ʽΪCH���ɼ����к�̼���ߣ�
(3)����ȼ�����ɶ�����̼��ˮ����Ӧ����ʽΪ��CH4+2O2![]() CO2+2H2O����ȼ�շ���ʽΪ��C6H6+
CO2+2H2O����ȼ�շ���ʽΪ��C6H6+![]() O2
O2![]() 6CO2+3H2O�������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ���DZ���
6CO2+3H2O�������ʵ����ı��ͼ���ֱ�ȼ�գ��������ϴ���DZ���
(4)���廯�������������£�����Һ�巢��ȡ����Ӧ�����屽��HBr����Ӧ����ʽΪ![]() ��
��

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�