题目内容
【题目】核安全与放射性污染防治已引起世界核大国的广泛重视。在爆炸的核电站周围含有放射性物质碘一131和铯一 137。碘—131—旦被人体吸入,可能会引发甲状腺等疾病。
(l)Cs(铯)的价电子的电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为_________,基态Z原子的核外电子排布式为______,X形成的单质晶体中含有的化学键类型是_________________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为______、______,BeF2分子的立体构型是____________,H2O分子的立体构型是________________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BC13分子中B—C1键的键角为__________________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有____个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻______个I-。

(5)KI晶体的密度为ρg cm 3,K和I的摩尔质量分别为MK g mol-1和M1g mol-1,原子半径分别为rKpm和r1 pm,阿伏加德罗常数值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为_____________。
【答案】 Li、Na、K ls22s22p63s23p64sl 金属键 sp sp3 直线形 V形 120° 4 6 ![]() ×100%
×100%
【解析】(1)由铯的最外层电子排布式为6s1,可知A、B、C为第ⅠA族,ⅠA族前四周期的元素分别为H、Li、Na、K,由电离能表可知,A、B的第一电离能的差值与B、C的第一电离能的差值相差不大,所以A、B、C不可能有H元素,而同主族元素电子层数越多,第一电离能越小,故A、B、C分别为Li、Na、K;基态Z原子的核外电子排布式为:1S22S22P63S23P64S1;金属晶体,微粒间均以金属键结合。
(2)BeF2中,B的价层电子对数是2+![]() (2-2)=2,所以Be是sp杂化,空间构型为直线型;H2O中O的价层电子对数是2+
(2-2)=2,所以Be是sp杂化,空间构型为直线型;H2O中O的价层电子对数是2+![]() (6-2)=4,所以O是sp3杂化,空间构型为V型。
(6-2)=4,所以O是sp3杂化,空间构型为V型。
(3)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为![]() =3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。
=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。
(4)由碘晶胞结构图可知,碘分子位于晶胞的8个顶点和6个面上,故一个晶胞中含有4个I2分子;KI晶胞与NaCl晶胞结构相似,每个K+紧邻6个I-,同层的4个,上下各一个。
(5)由已知及上述分析,晶胞中原子所占的体积V1=(![]() πrK3×4+
πrK3×4+![]() πrI3×4)×10-30,晶胞的体积V2=
πrI3×4)×10-30,晶胞的体积V2=![]() =4×
=4×![]() ,故KI晶胞中原子的体积占晶胞体积的百分率为:
,故KI晶胞中原子的体积占晶胞体积的百分率为: ![]() ×100%,代入相应数据整理得,
×100%,代入相应数据整理得, 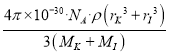 ×100%。
×100%。

 小学课时特训系列答案
小学课时特训系列答案