题目内容
18.下列有关元素周期律的叙述正确的是( )| A. | 随着原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着原子序数的递增,仅有元素的化合价出现周期性的变化 | |
| D. | 元素性质的周期性变化是仅指原子半径的周期性变化 |
分析 A、在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2;
B、根据周期表中元素的性质的变化规律分析;
C、随着原子序数的递增,原子半径、化合价和金属性非金属性均呈周期性变化;
D、元素性质的周期性变化不仅是指原子半径的周期性变化.
解答 解:A、从第二周期开始,随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现,而在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2,故A错误;
B、在周期表中元素的性质随着原子序数的递增而呈周期性变化,故B正确;
C、随着原子序数的递增,核外电子排布、原子半径、化合价和金属性非金属性均呈周期性变化,故C错误;
D、元素性质的周期性变化是指核外电子排布、原子半径、化合价和金属性非金属性的周期性变化,故D错误.
故选B.
点评 本题考查元素周期律的实质,明确原子的结构与性质的关系、元素的性质有哪些是解答的关键,并注意不能用元素本身的性质来解释元素性质的周期性变化.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.某有机物A的结构为( ),下列关于A的叙述中错误的是( )
),下列关于A的叙述中错误的是( )
 ),下列关于A的叙述中错误的是( )
),下列关于A的叙述中错误的是( )| A. | 该物质在一定条件下能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱(1H-NMR)上共有7个峰 | |
| C. | 1 mol该物质最多能与含1 mol Br2的溴水发生取代反应 | |
| D. | 该物质能与Na、NaOH、NaHCO3、盐酸等物质反应 |
13.已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 | |
| B. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| C. | KClO3分解速率快慢主要取决于反应② | |
| D. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 |
10.在50mL试管中充满15mL Cl2和35mL H2,受强光照射一定时间后,试管倒立在冷水中,进入试管中的水的体积是( )
| A. | 30mL | B. | 25mL | C. | 20mL | D. | 0mL |
7.用NA表示阿伏加德罗常数的值,下列有关说法中正确的是( )
| 选项 | 相关物质 | 相关说法 |
| A | 1mol CH3COONa和少量CH3COOH溶于水所得的中性溶液中 | CH3COO-数目为NA |
| B | Na2O和Na2O2的混合物共1mol | 阴离子数目可能为1.5NA |
| C | 向含2mol H2SO4的浓硫酸中加入足量的Zn粉,加热充分反应 | 转移的电子数为2NA |
| D | 3.0g由淀粉和葡萄糖组成的混合物中 | 所含的碳原子数为0.1NA |
| A. | A | B. | B | C. | C | D. | D |

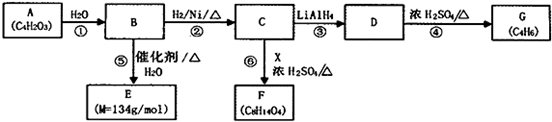
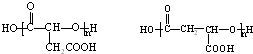 .
.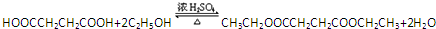 .
. .
.