题目内容
【题目】工业上可用CO2与H2反应生成甲醇,在T ℃下,将1 mol CO2和2 mol H2充入5 L恒容密闭容器中发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如下图中曲线Ⅰ所示。
CH3OH(g)+H2O(g),测得H2的物质的量随时间的变化情况如下图中曲线Ⅰ所示。

(1)按曲线Ⅰ计算反应从0到4 min时,v(H2)=____________________。
(2)在T ℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为_______________________________________;
反应按曲线Ⅱ进行,计算达到平衡时容器中c(CO2)=______________。
(3)判断该反应达到平衡的依据为________(填字母)。
A.混合气体的平均相对分子质量不随时间改变
B.3v(H2)正=v(CH3OH)逆
C.混合气体的压强不随时间改变
D.单位时间内生成CH3OH和H2O的物质的量相同
【答案】 0.05 mol·L-1·min-1 增大二氧化碳的浓度(或增加CO2的量) 2.4 mol·L-1 AC
【解析】(1)按曲线Ⅰ计算反应从0到4 min时,v(H2)=![]() =
=![]() =0.05 mol·L-1·min-1;(2)根据到达平衡的时间减少,氢气也减少,平衡正向移动,说明是增大二氧化碳的浓度;反应按曲线Ⅱ进行,达到平衡时容器中n(H2)=0.5mol,
=0.05 mol·L-1·min-1;(2)根据到达平衡的时间减少,氢气也减少,平衡正向移动,说明是增大二氧化碳的浓度;反应按曲线Ⅱ进行,达到平衡时容器中n(H2)=0.5mol,
根据反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)在条件Ⅰ时:
CH3OH(g)+H2O(g)在条件Ⅰ时:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始时的浓度/mol/L 0.2 0.4 0 0
改变的浓度/mol/L ![]() 0.2
0.2 ![]()
![]()
平衡时的浓度/mol/L ![]() 0.2
0.2 ![]()
![]()
则K=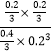 =
=![]() ,而在条件Ⅱ只增大二氧化碳的浓度,则设平衡时c(CO2)=x,有:
,而在条件Ⅱ只增大二氧化碳的浓度,则设平衡时c(CO2)=x,有:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始时的浓度/mol/L ? 0.4 0 0
改变的浓度/mol/L ![]() 0.3
0.3 ![]()
![]()
平衡时的浓度/mol/L ![]() 0.1
0.1 ![]()
![]()
温度不变,则K不变,有K=![]() =
=![]() ,解得x= 2.4,则 c(CO2)=2.4mol·L-1;
,解得x= 2.4,则 c(CO2)=2.4mol·L-1;
(3) A.该反应为气体体积减小的反应,气体总质量不变,但气体的总物质的量会由平衡移动而变,故混合气体的平均相对分子质量不随时间改变时说明已达平衡状态,选项A正确;B v(H2)正=3v(CH3OH)逆是说明正逆反应速率相等,达到平衡状态,选项B错误;C、该反应为气体体积减小的反应,气体的总物质的量会由平衡移动而变,故混合气体的压强不随时间改变时说明已达平衡状态,选项C正确;D、同一个方向的速率,没有反映出正、逆两个方向,选项D错误。答案选AC。

