题目内容
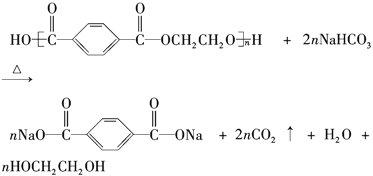
【题目】目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的。利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下:
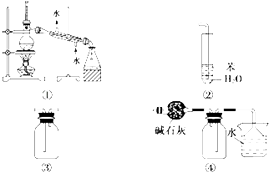
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计。依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇。缓慢搅拌,油浴加热,升温到180℃,反应15min。
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏。
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解。抽滤除去少量不溶物。
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸。
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL1:1HCl酸化,酸化结束,体系呈白色浆糊状。
步骤6:冷至室温后再用冰水冷却。抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥。
(1)步骤1反应过程中的现象是_________________________________________。
(2)步骤2是为了分离出________。
(3)步骤3抽滤需要用到的主要仪器有____________________________________。
(4)步骤4加沸石的目的是____________________________________________。
(5)步骤5用盐酸酸化的目的是__________________________________________。
(6)步骤6用丙酮洗涤的目的是_________________________________________。
【答案】 固体溶解,有气泡产生 乙二醇 布氏漏斗、吸滤瓶 防止暴沸 将对苯二甲酸钠转化为对苯二甲酸 便于干燥
【解析】(1)根据方程式知,饮料瓶碎片逐渐和碳酸氢钠反应生成二氧化碳,所以看到的现象是固体溶解,有气泡产生,故答案为:固体溶解,有气泡产生;
(2)乙二醇熔沸点较低,减压蒸馏,有利于乙二醇分离,故答案为:乙二醇;
(3)抽滤需要用到的主要仪器有布氏漏斗和吸滤瓶,故答案为:布氏漏斗、吸滤瓶;
(4)沸石的作用是防止液体剧烈沸腾,防止溅出液体而产生安全事故,所以加入沸石的目的是防止暴沸,故答案为:防止暴沸;
(5)对苯二甲酸钠和盐酸能反应生成对苯二甲酸,从而实现实验目的,故答案为:将对苯二甲酸钠转化为对苯二甲酸;
(6)丙酮具有挥发性,便于干燥,故答案为:便于干燥。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案