题目内容
【题目】实验是化学研究的基础.下列关于各实验装置的叙述正确的是( ) 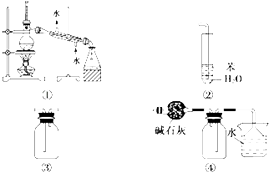
A.装置①常用于分离乙醇或苯等与水组成的混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NO等气体
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
【答案】D
【解析】解:A.分离乙醇与水组成的混合物利用蒸馏装置,分离苯与水的混合物可选择分液装置,则装置①常用于分离乙醇与水组成的混合物,故A错误;
B.苯的密度比水小,不能使极易溶于水的气体与水隔离,则应将苯改为四氯化碳可用装置②吸收NH3或HCl气体,并防止倒吸,故B错误;
C.NO不能利用排空气法收集,装置③中长导管进入可收集CO2、Cl2 , 短导管进入可收集H2 , 故C错误;
D.碱石灰干燥氨气,进气导管短为向下排空气法收集,倒扣的漏斗可防止倒吸,图中干燥、收集氨气,并吸收多余的氨气装置合理,故D正确;
故选D.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目